
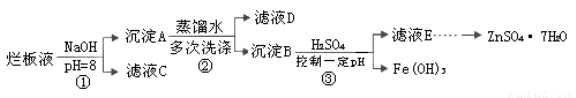
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
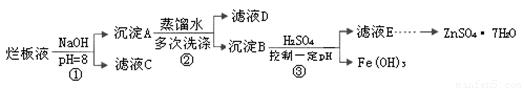
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq)
; ΔH= a kJ•mol-1
Fe3+(aq)+3OH-(aq)
; ΔH= a kJ•mol-1
②H2O(l)
 H+(aq)+OH-(aq) ;ΔH= b
kJ•mol-1
H+(aq)+OH-(aq) ;ΔH= b
kJ•mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
(1)1:2
(2)Zn(OH)2+2OH-=ZnO22-+2H2O
(3)Cl-、NO3-
(4)C
(5)将pH试纸放在玻璃片上,用玻璃棒醮取待测点在试纸中间,待颜色变化稳定后与比色卡对比,读出读数
(6)Fe3+(aq) +3H2O(l)  Fe(OH)3(s) +3H+(aq)
△H=(3b-a)kJ·mol-1
Fe(OH)3(s) +3H+(aq)
△H=(3b-a)kJ·mol-1 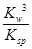
【解析】
试题分析:(1)4Zn+10HNO3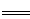 4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。
4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。
(2)偏铝酸钠在水溶液中都是以Na[Al(OH)4]的形式存在,以前只不过是为了方便,把它简写成NaAlO2。但它的实际组成还是Na[Al(OH)4]。 NaAlO2偏铝酸钠是简写,就像氢离子(H+)实际上是水合氢离子一样。[Zn(OH)4]-与此相类似。
(4)在一定条件下,难溶强电解质AmBn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,叫作沉淀溶解平衡。这时,离子浓度的乘积为一常数,叫作溶度积,用Ksp表示。很明显,滤液E的pH=4时,Zn(OH)2已经溶解,所以无法求得溶度积,而Fe(OH)3是已沉淀形式存在,所以可以求得。
(6)由②×3-①即可得到Fe3+(aq)
+3H2O(l)  Fe(OH)3(s) +3H+(aq)
△H=(3b-a)kJ·mol-1 。
Fe(OH)3(s) +3H+(aq)
△H=(3b-a)kJ·mol-1 。
Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-) KW=c(OH-)·c(H+)
Fe3+发生水解反应的平衡常数:K=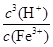 =
=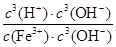 =
=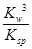
考点:化学综合运用。


科目:高中化学 来源:2013-2014学年甘肃省高三下学期第一次诊断考试理综化学试卷(解析版) 题型:填空题
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是??????? 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式???????????????????????????????????????????????? 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有????????????? (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是??????? (填选项)。
A.Ksp[Zn(OH)2]??? B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3]??? C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是:?????????????????? 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH= a kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH= a kJ?mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH= b kJ?mol-1
H+(aq)+OH-(aq) ;ΔH= b kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式:???????????????????????????? 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K=????????????????? 。(用含KSP、KW的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com