
A.2 B.4 C.6 D.8
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
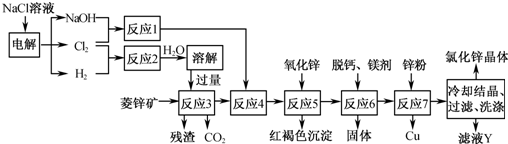
14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1) 将菱锌矿研磨成粉的目的是 。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6× | — | 6.8× | 2.8× |
(5)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(6)抽滤装置如下图所示,该装置中的错误之处是___________;抽滤完毕或中途需停止抽滤时,应先_________________________,然后_______________________。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高三上学期第一次月考化学试卷(解析版) 题型:填空题
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下:
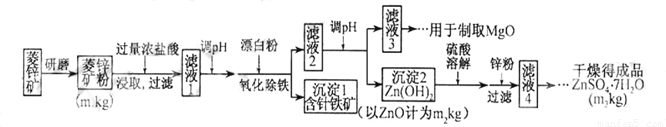
(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀的pH[来源 |
10.4 |
6.4 |
— |
— |
|
沉淀完全的pH |
12.4 |
8.0 |
— |
— |
|
开始溶解的pH |
— |
10.5 |
— |
— |
|
Ksp |
5.6× |
— |
6.8× |
2.8× |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉b.石灰乳c.纯碱溶液d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省揭阳市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 。


图1: SO2 的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是 。
(3)加入MnS的目的是 。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程,计算结果保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com