


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
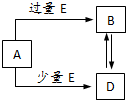 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )| A、若A是铁,则E可能为稀硝酸 |
| B、若A是CuO,E是碳,则B为CO |
| C、若A是AlCl3溶液,E可能是氨水 |
| D、若A是NaOH溶液,E是CO2,则B为NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2+HNO3+H2O |
| B、N2+NH3+H2O |
| C、NH3+HNO3 |
| D、NH3+NO+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B的物质的量浓度 |
| B、混合气体的密度 |
| C、混合气体的平均相对分子质量 |
| D、混合气体的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl溶液中有杂质Na2SO4(氯化钡) |
| B、FeSO4溶液中有杂质CuSO4(铁粉) |
| C、Na2SO4溶液中有杂质Na2CO3(盐酸) |
| D、BaCl2溶液中有少量MgCl2(Ba(OH)2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl和SO3溶于水后都能导电,故KCl和SO3均为电解质 |
| B、相同浓度和体积的强酸与强碱溶液混合后,溶液的pH=7 |
| C、向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D、AgCl易转化为AgI沉淀且Ksp(AgX)=c(Ag+)?c(X-),故Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气通入KI溶液中:Cl2+2I-═2Cl-+I2 |
| B、氯气溶于水中:Cl2+H2O═H++Cl-+HClO |
| C、碳酸氢钠溶液与硝酸反应:HCO3-+H+═H2O+CO2↑ |
| D、氯化铁溶液中加入过量氨水:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com