
我国卫星发射所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料。NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g)====2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)====N2(g)+2H2O(g) ΔH=-534 kJ·mol-1。
下列关于肼和NO2反应的热化学方程式中正确的是( )
A.2N2H4(g)+2NO2(g)====3N2(g)+4H2O (l) ΔH=+1 135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(l) ΔH=-1 135.7 kJ·mol-1
C.N2H4(g)+NO2(g)====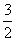 N2(g)+2H2O(g) ΔH=+1 135.7 kJ·mol-1
N2(g)+2H2O(g) ΔH=+1 135.7 kJ·mol-1
D.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(g) ΔH=-1 135.7 kJ·mol-1
科目:高中化学 来源: 题型:
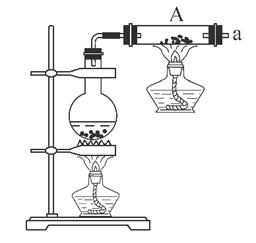
(1)铁粉与水蒸气反应的化学方程式是: ;
(2)为检验生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示)a— ,描述能证明气体产物的实验现象_ ;
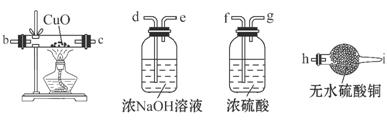
(3)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法: ;
(4)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(用化学方程式说明): ;
(5)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是: ;
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有同学设计如下图所示的装置: 通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
A.电源中的a为正极,b为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是( )
A.2SO2(g)+O2(g)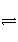
 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
B.2SO2(g)+O2(g)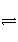
 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
C.SO2(g)+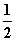 O2(g)
O2(g)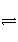
 SO3(g) ΔH=98.3 kJ·mol-1
SO3(g) ΔH=98.3 kJ·mol-1
D.SO2(g)+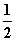 O2(g)
O2(g)
 SO3(g) ΔH=-196.6 kJ·mol-1
SO3(g) ΔH=-196.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿外导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4 mol电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )
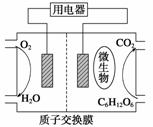
A.该电池能够在高温下工作
B.电池的负极反应式为C6H12O6+6H2O—→6CO2↑+24H++24e-
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体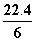 L
L
查看答案和解析>>
科目:高中化学 来源: 题型:
有关热化学方 程式书写与对应表述均正确的是( )
程式书写与对应表述均正确的是( )
A.稀醋酸与0.1 mol·L-1 NaOH溶液反应:
H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1
B.氢气的燃烧热为285.5 kJ·mol-1, 则水分解的热化学方程式
2H2O(l)====2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
C.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。 则Fe(s)+S(s)====FeS(s) ΔH=-95.6 kJ·mol-1
D.已知2C(s)+O2(g)====2CO(g) ΔH=-221 kJ·mol-1,则可知C的燃烧热为110.5 kJ·m ol-1
ol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
将下图所示实验装置的K闭合,下列判断正确的是( )
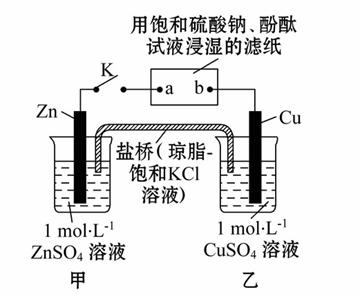
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下测得在2 L的容器中,M、N、P三种气体物质的量的变化如图所示,则有关该反应的说法正确的是( )
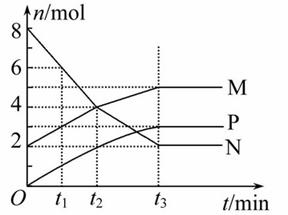
A.该温度下的平衡常数为3.75
B.若升高温度,测得M的转化率增大,则该反应的正反应为吸热反应
C.t3时,正反应速率大于逆反应速率
D.若测得 该反应在一段时间内压强不变,说明反应达到平衡
该反应在一段时间内压强不变,说明反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是元素周期表的一部分,已知A、B、C、D、E均为短周期元素,D元素最外层电子数为最内层电子数的3倍,下列说法中正确的是( )
| A | B | C |
| D | E |
A.元素A位于第二周期ⅣA族
B.原子半径:B>C
C.最高价氧化物对应水化物的酸性:C>E
D.气态氢化物的稳定性:D>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com