

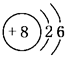 (2)4 (3)12(4) C<O<N (N>O>C) CH4 (5)AD
(2)4 (3)12(4) C<O<N (N>O>C) CH4 (5)AD  。(2)SiO2是原子晶体,每个Si原子与4个O原子形成4个Si—O共价键。所以在1moSiO2中,有4mol Si—O键。(3)CO2在固态时是分子晶体,其晶体类型为立方面心结构。所以在每个晶胞中与它距离最近的CO2分子的个数为3个,通过一个CO2可以形成8个晶胞,而且每个CO2都重复了2次,所以在化合物CO2的晶体中,每个CO2分子周围与它距离最近的CO2分子有(8×3)÷2=12.(4)由于元素X原子序数介于B、C之间,所以X是N元素。它与C、O都可与与A形成的10e-的化合物。由于A的原子序数小于6 ,则A为H元素。一般情况下,原子序数越大,元素的电负性越大,元素的第一电离能就越大。但是由于N原子核外的电子排布处于半充满的稳定状态,所以去第一电离能比O还要大些。因此C、N、O三元素的第一电离能大小关系为:N>O>C或C<O<N。三种元素形成的10e-的化合物是CH4、NH3、H2O。由于N、O电负性大,原子半径小,所以在NH3、H2O的分子之间除了存在分子间作用力外还存在氢键,而CH4的分子之间只存在分子间作用力。因此甲烷的沸点最低。(5)A.由晶胞结构示意图可知:在该晶胞中含有K+:8×1/8+6×1/2=4;O2-:1+12×1/4=4.所以K+:O2-=1:1;在一个晶胞中含有KO2。正确。B.晶体中每个E+周围有6个O2-,每个C2-周围有6个K+.错误。C.晶体中与每个E+距离最近的E+有(8×3)÷2=12个.错误。D.在晶体中,假设0价O为x,-2价O为y。则x+y=2;0+(-2)y=-1.解得x=3/2;y=1/2。所以0价O与-2价O的数目比为3:1。正确。E.O2-电子数为17,与N2电子数为14.所以二者不能互为等电子体。错误。2、CO2、KO2的晶体结构及晶胞中含有的微粒数目及第一电离能的大小比较的知识。
。(2)SiO2是原子晶体,每个Si原子与4个O原子形成4个Si—O共价键。所以在1moSiO2中,有4mol Si—O键。(3)CO2在固态时是分子晶体,其晶体类型为立方面心结构。所以在每个晶胞中与它距离最近的CO2分子的个数为3个,通过一个CO2可以形成8个晶胞,而且每个CO2都重复了2次,所以在化合物CO2的晶体中,每个CO2分子周围与它距离最近的CO2分子有(8×3)÷2=12.(4)由于元素X原子序数介于B、C之间,所以X是N元素。它与C、O都可与与A形成的10e-的化合物。由于A的原子序数小于6 ,则A为H元素。一般情况下,原子序数越大,元素的电负性越大,元素的第一电离能就越大。但是由于N原子核外的电子排布处于半充满的稳定状态,所以去第一电离能比O还要大些。因此C、N、O三元素的第一电离能大小关系为:N>O>C或C<O<N。三种元素形成的10e-的化合物是CH4、NH3、H2O。由于N、O电负性大,原子半径小,所以在NH3、H2O的分子之间除了存在分子间作用力外还存在氢键,而CH4的分子之间只存在分子间作用力。因此甲烷的沸点最低。(5)A.由晶胞结构示意图可知:在该晶胞中含有K+:8×1/8+6×1/2=4;O2-:1+12×1/4=4.所以K+:O2-=1:1;在一个晶胞中含有KO2。正确。B.晶体中每个E+周围有6个O2-,每个C2-周围有6个K+.错误。C.晶体中与每个E+距离最近的E+有(8×3)÷2=12个.错误。D.在晶体中,假设0价O为x,-2价O为y。则x+y=2;0+(-2)y=-1.解得x=3/2;y=1/2。所以0价O与-2价O的数目比为3:1。正确。E.O2-电子数为17,与N2电子数为14.所以二者不能互为等电子体。错误。2、CO2、KO2的晶体结构及晶胞中含有的微粒数目及第一电离能的大小比较的知识。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CS2为V形的极性分子 | B.ClO3-的空间构型为平面三角形 |
| C.SF6中的空间构型为正四面体形 | D.SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键 mol。
键 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com