
【题目】下列化学方程式或离子方程式书写正确的是( )
A.钠在空气中燃烧:4Na+O2![]() 2Na2O
2Na2O
B.Na2S2O3溶液与稀硫酸的反应:S2O![]() +4H+═SO3+S↓+2H2O
+4H+═SO3+S↓+2H2O
C.浓硝酸与铜片的反应:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
D.用铁氰化钾溶液检验Fe2+:Fe2++[Fe(CN)6]2-═Fe[Fe(CN)6]↓
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为![]() 下列关于该电池的说法不正确的是( )
下列关于该电池的说法不正确的是( )
A.充电时,若转移![]() ,石墨(
,石墨(![]() )电极将增重
)电极将增重![]()
B.充电时,阳极的电极反应式为![]()
C.放电时,![]() 在电解质中由负极向正极迁移
在电解质中由负极向正极迁移
D.放电时,负极的电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为_________,价层电子的轨道表达式为_________。
(2)Ni的两种配合物结构如图所示:
A B
①A 的熔、沸点高于B的原因为_________。
②A晶体含有化学键的类型为___________(填选项字母)。
A.σ键 B.π键 C.配位键 D.金属键
③A晶体中N原子的杂化形式是_________。
(3) 人工合成的砷化镍常存在各种缺陷,某缺陷砷化镍的组成为Ni1.2As, 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为_________。
(4) NiAs的晶胞结构如图所示:

①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的砷离子之间的距离为_________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法正确的是( )
A.相同条件下,形状大小相同的Mg、Al 分别与同浓度的盐酸反应的速率相同
B.使用合适的催化剂可以加快反应速率,但不能提高反应物的转化率
C.在容积固定的恒温密闭容器中,发生合成NH3的反应,充入He,反应速率增大
D.10mL0.5mol·L-1的FeCl3溶液加入10mL的0.5mol·L-1的KSCN 溶液,充分反应后加入KCl固体,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
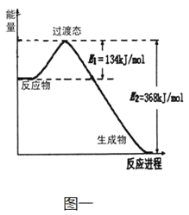
【题目】20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO 过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________。在反应体系中加入适宜的催化剂(正催化剂),E1和E2的变化是:E1_______,E2_____(填“增大”、“减小”或“不变”),对反应热有无影响?________,原因是_______。
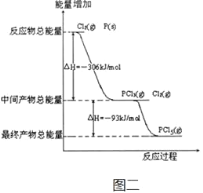
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
①PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式_______。
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______△H1(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物在工农业生产中具有重要地位。请按要求回答下列问题。
Ⅰ.纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法a | 用葡萄糖还原新制的Cu(OH)2(NaOH过量)制备Cu2O |
方法b | 用肼(N2H4)加热还原新制的Cu(OH)2制备Cu2O,同时放出N2 |
方法c | 用炭粉在1000℃以上还原CuO制备Cu2O,同时放出CO |
(1)写出方法a的化学方程式:__。
(2)已知:①2Cu(s)+![]() O2(g)=Cu2O(s) △H=-169kJ·mol﹣1
O2(g)=Cu2O(s) △H=-169kJ·mol﹣1
②C(s)+![]() O2(g)=CO(g) △H=-110.5kJ·mol﹣1
O2(g)=CO(g) △H=-110.5kJ·mol﹣1
③CuO(s)=Cu(s)+![]() O2(g) △H=+157kJ·mol﹣1
O2(g) △H=+157kJ·mol﹣1
写出方法c反应的热化学方程式:__。
(3)在相同的密闭容器中,用上表方法制得的三种Cu2O分别进行催化分解水的实验:2H2O(g)![]() 2H2(g)+O2(g) △H>0。水蒸气的浓度随时间t变化如下表所示:
2H2(g)+O2(g) △H>0。水蒸气的浓度随时间t变化如下表所示:
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
i | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 | ii | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
iii | T2 | 0.100 | 0.0960 | 0.0930 | 0.0900 | 0.0900 | 0.0900 |
对比上述实验数据,可获得的结论:
①催化剂的催化效率:实验i___实验ii(填“>”“<”“=”,下同)。
②T1__T2。
Ⅱ.在2L的恒温密闭容器中通入5molO2并加入足量Cu2S发生反应:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H1=-271.4kJ/mol,
反应过程中某气体的体积分数随时间变化如图所示。
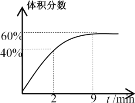
(4)反应前2min平均反应速率v(SO2)=__;该温度下反应的平衡常数K=__。
若保持温度不变向平衡体系中再通入1molO2,达到新平衡后氧气的体积分数__(填“大于”“小于”或“等于”)原平衡时氧气的体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于我国煤储藏量相对比石油和天然气丰富,能源消费以煤为主。将原煤作为燃料燃烧,既严重污染环境,效率又不高,因而国家大力提倡煤的综合利用。实施“煤变油”,其原理之一是先将煤与水蒸气制得水煤气(一氧化碳和氢气),再催化合成甲醇或烃类等液态能源。
(1)用一氧化碳和氢气合成甲醇的化学方程式是______________________________________。
(2)用一氧化碳和氢气合成烃(CnHm)的化学方程式是__________________________。
(3)气化和液化的优点是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com