
分析 (1)依据配制溶液体积选择合适容量瓶,依据m=CVM计算需要溶质的质量;
(2)依据配制一定物质的量浓度溶液的一般步骤选择需要仪器;依据天平称重原原理:左盘的质量=右盘的质量+游码的质量及c=$\frac{n}{V}$进行判断;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签等,据此排序;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据c=$\frac{n}{V}$进行误差分析.
解答 解:(1)实验需要480mL0.1mol/LNa2CO3溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=0.1mol/L×0.5L×106g=5.3g;
故答案为:5.3;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,需要480mL0.1mol/LNa2CO3溶液,实验室没有480mL容量瓶,应选择500mL容量瓶,所以还缺少的仪器:500mL容量瓶;
需要Na2CO3•10H2O的质量0.05mol×286g/mol=14.3g,因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,一但物体和砝码位置反了,读数时用到了游码,则称得的实际质量减小,
故答案为:500mL容量瓶;B;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶贴标签等,所以正确的操作步骤为:BCAFED;
故答案为:BCAFED;
(4)①没有进行A操作,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
故答案为:偏低;
②家蒸馏水时不慎超过了刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;
③定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏高;
④溶液未恢复至室温就注入容量瓶,导致冷却后溶液体积偏小,溶液浓度偏高;
故答案为:偏高.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,明确配制原理及操作步骤是解题关键,属于基础型题目,难度不大,注意容量瓶规格选择及托盘天平称量原理及使用方法.


科目:高中化学 来源: 题型:选择题
| A. | CuO→Cu(OH)2 | B. | CaCO3→CaCl2 | C. | Na2SO4→NaCl | D. | Mg(NO3)2→KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳在高温下和二氧化碳的反应 | B. | 碳不完全燃烧 | ||
| C. | 氯化铵与氢氧化钡晶体的反应 | D. | 铝和氧化铁在高温下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、SO42- | B. | Cu2+、Cl-、NO3-、OH- | ||
| C. | Ca2+、Na+、CO32-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
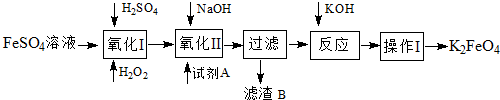
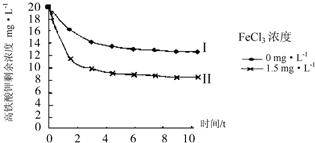
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放电时,正极发生的反应是Pb+SO42-═PbSO4+2e- | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4+2e-═Pb+SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com