
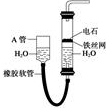
 用图中的实验装置制取乙炔.
用图中的实验装置制取乙炔.分析 (1)实验室通过电石与水的反应制取乙炔;
(2)乙炔能使酸性高锰酸钾溶液褪色,发生了氧化反应;
(3)利用乙炔与溴发生加成反应进行判断;
(4)CH4和C2H2的混合气体,通过足量的溴水充分吸收后,溴水增重13g为C2H2质量,进而计算CH4的质量,根据n=$\frac{m}{M}$计算CH4、C2H2的物质的量,相同条件下体积之比等于物质的量之比,据此计算判断.
解答 解:(1)制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,
故答案为:酸性KMnO4溶液褪色;氧化;
(3)乙炔能够和溴水发生加成反应,溴的四氯化碳溶液褪色,
故答案为:加成.
(4)CH4和C2H2的混合气体,通过足量的溴水充分吸收,溴水增重13g为C2H2质量,则CH4的质量=21g-13g=8g,
故n(CH4)=$\frac{8g}{16g/mol}$=0.5mol、n(C2H4)=$\frac{13g}{26g/mol}$=0.5mol,
相同条件下体积之比等于物质的量之比,故V(CH4):V(C2H2)=0.5mol:0.5mol=1:1,
故答案为:1:1.
点评 本题考查乙炔的实验室制法及其性质,侧重基础知识的考查,利用所学知识即可完成,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-═H2↑ | B. | Fe-2e-═Fe2+ | ||
| C. | 4OH--4e-═2H2O+O2↑ | D. | Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 金属钛有可能在21世纪得到广泛运用 | |
| C. | 广泛运用铝合金,是因为铝不能与酸、碱、O2等反应 | |
| D. | 目前世界上用途最广的合金是钢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
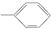 ⑤-CHO.
⑤-CHO.| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| ① | 碳酸钙与醋酸反应 | CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| ② | 氢氧化钠溶液中通入CO2 | OH-+CO2=HCO3- | 错误,通往过量CO2应生成CO32- |
| ③ | NaHCO3的水解 | HCO3-+H2O?H2CO3+OH- | 正确 |
| ④ | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 正确 |
| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com