
| 元素 | X | Y | Z | W | R |
| 相 关 信 息 | 能形成+7价的化合物 | 日常生活中常见的金属,熔化时并不滴落,好像有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子,它是空气的主要成分之一 | 焰色反应为黄色 | 位于第ⅣA族,是形成化合物种类最多的元素 |


分析 X~R是元素周期表中的短周期元素,X能形成+7价的化合物,则X为Cl;Y是日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着,则Y为Al;Z通常状况下能形成短周期中最稳定的双原子分子,它是空气的主要成分之一,该分子为氮气,则Z为N;W焰色反应为黄色,则W为Na;R位于第IVA,是形成化合物种类最多的元素,则R为C,据此进行解答.
解答 解:X~R是元素周期表中的短周期元素,X能形成+7价的化合物,则X为Cl;Y是日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着,则Y为Al;Z通常状况下能形成短周期中最稳定的双原子分子,它是空气的主要成分之一,该分子为氮气,则Z为N;W焰色反应为黄色,则W为Na;R位于第IVA,是形成化合物种类最多的元素,则R为C.
(1)X为Cl,原子序数为17,处于周期表中第三周期ⅦA族,故答案为:第三周期ⅦA族;
(2)元素W的离子为Na+,Na+离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)元素R的最高价氧化物为CO2,电子式为 ,故答案为:
,故答案为: ;
;
(4)X、Z两元素的氢化物分别为HCl、NH3,二者化合得到NH4Cl,含有离子键、共价键,其溶液中NH4+离子水解,溶液呈酸性,溶液中离子浓度:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
故答案为:离子键、共价键;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(5)含Al的某化合物可用作净水剂,原因是铝离子在溶液中部分水解生成氢氧化铝胶体,氢氧化铝胶体具有很强吸附性,反应的离子方程式为:Al3++3H2O?Al(OH)3+3H+,
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+;
(6)Na2O2常用作舰艇、航天器的供氧剂,体现其反应原理的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查结构性质位置关系应用,侧重对化学用语与盐类水解的考查,题目难度中等,推断各元素为解答关键,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 标准状况下,2.24L Cl2与过量的稀FeI2溶液反应,转移电子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O $\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O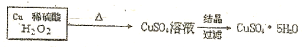 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.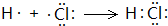 .
. ,尿素分子中σ键和π键数目之比为7:1.
,尿素分子中σ键和π键数目之比为7:1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | 动植物生长不可缺少的元素,是组成蛋白质的重要元素 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
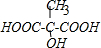 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中氢元素有三种同位素,它们的性质相同 | |
| B. | 三种同位素在化学反应中容易失去一个电子而呈+1价 | |
| C. | ${\;}_{1}^{1}$H原子失去一个电子后变成一个质子 | |
| D. | 氢在周期表中与碱金属同属ⅠA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com