
【题目】实验室欲配制1mol/LNaOH溶液240ml,请回答:
(1)需称取NaOH固体____________g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小___________(填字母),并在下图中选出能正确表示游码位置的选项_________(填字母)。

(2)选用的主要玻璃仪器除烧杯、玻璃棒外还有________________________。
(3)下列操作的顺序是(用序号表示)_________________。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)下列情况对所配制的NaOH溶液浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏洗涤后残留有少量的水________________
②将热的溶液直接移入了容量瓶________________
③定容时,仰视容量瓶的刻度线________________
④转移溶液时,玻璃棒的下端在容量瓶的刻度线以上________________
【答案】10.0cdh250ml容量瓶 胶头滴管BCAFED无影响偏大偏小偏小
【解析】
(1)根据m=nM=cVM计算氢氧化钠的质量;氢氧化钠具有腐蚀性且易潮解,应放在烧杯内称量,根据氢氧化钠与烧杯质量确定需要的砝码;由表中升高可知,最小的砝码为5g,故游码的最大刻度为5g,故小于5g用游码;(2)根据配制溶液的实验操作过程选择需要的玻璃仪器;(3)根据配制溶液的实验操作过程确定操作的顺序;(4)分析操作对溶质的物质的量、溶液体积的影响,根据c=![]() 分析操作对所配溶液浓度的影响。
分析操作对所配溶液浓度的影响。
(1)配制500mL1mol?L-1NaOH溶液需要氢氧化钠的质量为0.5L×0.5mol/L×40g/mol=10.0g;氢氧化钠具有腐蚀性且易潮解,应放在烧杯内称量,根据氢氧化钠与烧杯总质量为10.0g+23.1g=33.1g,故应选择20g与10g的砝码,即选择cd;由表中升高可知,最小的砝码为5g,故游码的最大刻度为5g,故小于5g所以游码,所以游码应在3.1g的位置,故选择h。(2)实验中所用仪器有托盘天平、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙、量筒(可用可不用),故选用的主要玻璃仪器除烧杯、玻璃棒外还有250ml容量瓶和胶头滴管。(3)溶液配制的操作步骤有计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等操作,用托盘天平称量氢氧化钠,用药匙取药品,在烧杯中溶解(可用量筒加水),用玻璃棒搅拌,加速溶解,恢复到室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故操作顺序为BCAFED。(4)若容量瓶用蒸馏洗涤后残留有少量的水即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响;液有热胀冷缩的性质,浓硫酸稀释,放出大量的热,稀释后未恢复室温立即转移到容量瓶中定容,导致所配溶液体积减小,所配溶液浓度偏大;定容时仰视液面,导致溶液体积偏大,则浓度会偏小;转移溶液时,玻璃棒下端靠在容量瓶刻度线以上,溶质减小,导致结果偏小。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】用括号内的试剂和方法除去下列各物质的少量杂质,不正确的是 ( )
A. 苯中含有苯酚(浓溴水,过滤)
B. 乙酸钠中含有碳酸钠(乙酸、蒸发)
C. 乙酸乙酯中含有乙酸(饱和碳酸钠溶液、分液)
D. 溴乙烷中含有醇(水、分液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如图所示:
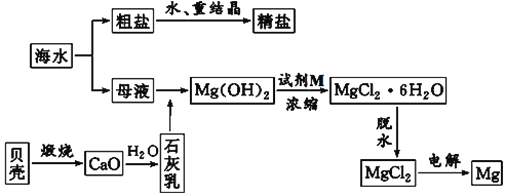
(1)海水提取镁要用到海滩上的贝壳,贝壳煅烧过程中发生反应的化学方程式为___________________________________________。
(2)母液中加入石灰乳反应的离子方程式为______。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时:_____________________________,
过滤时:_____________________________,
蒸发时:_____________________________。
(4)除去粗盐溶液中含有的![]() 、
、![]() 、
、![]() ,可依次加入
,可依次加入![]() 溶液、NaOH溶液、________,最后加入_________调节pH至中性。
溶液、NaOH溶液、________,最后加入_________调节pH至中性。
(5)写出金属镁在空气中燃烧的化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用25mL18.4mol/L的浓硫酸与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液稀释到100 mL,所得溶液中SO42-浓度为3mol/L,则此时溶液中CuSO4的物质的量浓度为
A. 0.5mol/L B. 1.6 mol/L C. 1.8 mol/L D. 3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 蛋白质遇浓硫酸变为黄色
B. 油脂为高分子化合物,分子结构中都含有酯基
C. 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,下层析出肥皂
D. 纤维素、麦芽糖在一定条件下均可转化为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaC1O3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaC1O3和NaI恰好完全反应,生成I2、Na2SO4和H2O,并产生棕黄色的气体X,则X为
A. Cl2 B. Cl2O C. Cl2O3 D. ClO2
【答案】D
【解析】试题分析:根据转移电子数守恒得,1molNaI中的碘元素由-1价生成单质碘,化合价升高转移1mol电子,故NaClO3中的氯元素化合价降低转移1mol电子,故X气体中氯元素的价态为+4价,答案选D.
考点:氧化还原反应
【题型】单选题
【结束】
25
【题目】把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是
A. 3.2g B. 4.8g C. 5.4g D. 6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L
B. V L Fe2(SO4)3溶液中含a g SO42-,取此溶液![]() L用水稀释成2V L,则稀释后溶液的c(Fe3+)为
L用水稀释成2V L,则稀释后溶液的c(Fe3+)为![]() mol/L
mol/L
C. 已知某NaCl溶液的密度是1.17 g/cm3,可求出此溶液的物质的量浓度
D. 把100mL20%的NaOH溶液跟100mL10%的NaOH 混合后,可判断NaOH混合溶液的质量分数等于15%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下有机物:① ![]() ②
② ![]() ③
③ ![]() ④
④ ![]() ⑤苯酚
⑤苯酚
(1)能与Na反应的是 ________ ;
(2)能与![]() 溶液反应的有_________;
溶液反应的有_________;
(3)能与NaHCO3溶液反应有气泡产生的是_______________;
(4)能与银氨溶液发生银镜反应的有____________________;
(5)既能发生消去反应,又能发生酯化反应的有___________________;
(6)能发生氧化反应的有(除燃烧以外)___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com