
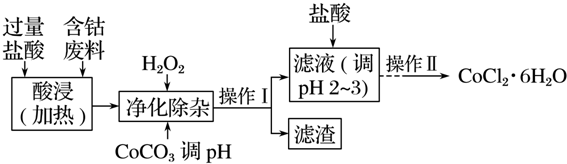
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
分析 向含钴废料中加入过量稀盐酸,Fe、Al和稀盐酸反应生成FeCl2、AlCl3、CoCl2,向溶液中加入双氧水和CoCO3,双氧水具有强氧化性,能将亚铁离子氧化为铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,加入CoCO3,调节溶液的pH至7.6,使Fe(OH)3、Al(OH)3生成沉淀,然后过滤,滤渣为Fe(OH)3、Al(OH)3,滤液中含有CoCl2,然后向滤液中加入稀盐酸,抑制CoCl2水解,然后采用蒸发浓缩、冷却结晶和过滤方法得到CoCl2•6H2O;
(1)双氧水具有氧化性,能氧化还原性离子;
(2)加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3;
(3)CoCl2为强酸弱碱盐,阳离子水解导致溶液呈酸性,加入稀盐酸能抑制水解;
(4)操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,其中洗涤的操作同过滤,用蒸馏水进行洗涤.
解答 解:向含钴废料中加入过量稀盐酸,Fe、Al和稀盐酸反应生成FeCl2、AlCl3、CoCl2,向溶液中加入双氧水和CoCO3,双氧水具有强氧化性,能将亚铁离子氧化为铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,加入CoCO3,调节溶液的pH至7.6,使Fe(OH)3、Al(OH)3生成沉淀,然后过滤,滤渣为Fe(OH)3、Al(OH)3,滤液中含有CoCl2,然后向滤液中加入稀盐酸,抑制CoCl2水解,然后采用蒸发浓缩、冷却结晶和过滤方法得到CoCl2•6H2O;
(1)双氧水具有强氧化性,能将亚铁离子氧化为铁离子,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(3)CoCl2为强酸弱碱盐,阳离子水解导致溶液呈酸性,加入稀盐酸能抑制水解,所以加入稀盐酸的目的是抑制CoCl2水解,
故答案为:抑制CoCl2水解;
(4)操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,其中洗涤的操作为在过滤器中加入蒸馏水使水没过晶体,静置,使其自然流下,重复2-3次,
故答案为:冷却结晶; 在过滤器中加入蒸馏水使水没过晶体,静置,使其自然流下,重复2-3次.
点评 本题考查物质分离和提纯及电解原理,为高频考点,涉及氧化还原反应、物质分离和提纯方法、盐类水解等知识点,侧重考查学生知识运用能力,难点是工业流程的分析,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{还原}^{H_{2}}$Si | |
| B. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) | |
| C. | FeS2$→_{还原}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | MgCO3$\stackrel{HCl(aq)}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
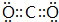
 ,用电子式表示化合物 C2D 的形成过程
,用电子式表示化合物 C2D 的形成过程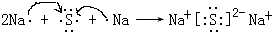 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
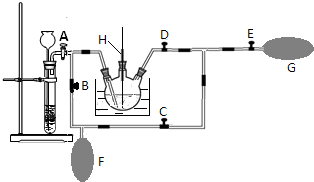
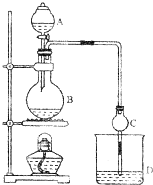 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(1)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ/mol | |
| B. | C8H18(1)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ/mol | |
| C. | C8H18(1)+$\frac{25}{2}$O2(g)=8CO2(g)+9H2O(l);△;△H=+5518kJ/mol | |
| D. | 2C8H18(1)+25O2(g)=16CO2(g)+18H2O(1);△H=-11036kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Tl+的最外层有1个电子 | B. | Tl3+的氧化性比Al3+强 | ||
| C. | Tl 能形成+3价和+1价的化合物 | D. | Tl+的还原性比Ag强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和甲烷的密度都比空气的小,所以都可用向下排气法收集 | |
| B. | 配制溶质质量分数一定的溶液时,所用的烧杯必须是干燥的 | |
| C. | 蜡烛燃烧后质量变小,说明质量守恒定律不是普遍规律 | |
| D. | 通过测定两种稀盐酸的pH,可以比较它们的酸性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com