
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 短周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
分析 A.主族元素的最高正化合价等于其最外层电子数(个别元素除外);
B.电子的能量越高,摆脱原子核束缚的能力越强,在离核远的区域运动;
C.过渡元素包含副族元素与第Ⅷ族元素;
D.电子层相同时核电荷数越大半径越小.
解答 解:A.主族元素的最高正化合价等于其最外层电子数(个别元素除外),而副族元素的价电子包含倒数第二层、甚至倒数第三层电子,故A错误;
B.电子的能量越高,摆脱原子核束缚的能力越强,在离核远的区域运动,电子能量越低,在离核较近的区域内运动,故B错误;
C.位于金属和非金属分界线附近的元素,表现一定的金属性与非金属性,而过渡元素包含副族元素与第Ⅷ族元素,故C错误;
D.电子层相同时核电荷数越大半径越小,所以短周期元素(除0族元素外)从左到右,原子半径逐渐减小,故D正确;
故选D.
点评 本题考查结构性质位置关系的应用,难度不大,侧重对基础知识的巩固,A选项为易错点,学生容易只考虑主族元素.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
 自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙 | 丙 | 实验结论 |  |
| A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:碳>硅 | |
| B | 双氧水 | MnO2 | Na2S | 氧化性:H2O2>O2>S | |
| C | 浓硫酸 | Na2SO3 | 酸性KMnO4溶液 | SO2具有漂白性 | |
| D | 浓氨水 | 氢氧化钠固体 | 酚酞 | 碱性:NaOH>NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| B. | 将煤气化后再作为能源,可减少PM2.5引起的危害 | |
| C. | 用激光笔分到照射盛有蓝墨水、FeCl3 溶液的玻璃杯均出现光亮的通路 | |
| D. | 氨气液化时能吸收大量的热,常用来做冷冻剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酯化反应的产物只有酯 | |
| B. | 酯化反应一般需要用NaOH溶液来吸收生成的酯 | |
| C. | 酯化反应是有限度的 | |
| D. | 浓硫酸可做酯化反应的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
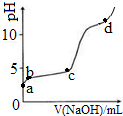 室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )
室温下,在0.2mol/LAl2(SO4)3溶液中,逐滴加入1.0mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )| A. | a点,离子方程式为:Al3++3OH-→Al(OH)3↓ | |
| B. | a~b段,溶液pH增大,促进了氢氧化铝的碱式电离 | |
| C. | b~c段,加入的OH-主要用于生成Al(OH)3沉淀 | |
| D. | d点时,Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
 .
. 、
、 、
、 、
、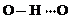 任意一种.
任意一种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com