
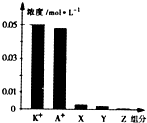
 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | 该混合溶液pH=7.0 | B. | 原HA溶液中:c(HA)>c(H+)>c(A-) | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 混合溶液中:c(X)+x(A-)=c(K+) |
分析 一元酸HA和KOH溶液等体积、等浓度0.1mol/L混合,HA+KOH=KA+H2O,所得溶液中A-浓度小于0.05mol/L,说明在溶液中存在A-+H2O?HA+OH-,KA水解,HA为弱酸,KA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(K+)=0.05mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒为:c(K+)=c(A-)+c(HA).
A.HA为弱酸;
B.HA为弱酸,部分电离,而溶剂水也电离产生氢离子;
C.X表示OH-,Y表示HA,Z表示H+;
D.Y表示HA,溶液中存在物料守恒得到c(A-)+c(Y)=c(K+).
解答 解:一元酸HA和KOH溶液等体积、等浓度0.1mol/L混合,HA+KOH=KA+H2O,所得溶液中A-浓度小于0.05mol/L,说明在溶液中存在A-+H2O?HA+OH-,KA水解,HA为弱酸,KA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(K+)=0.05mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,溶液中存在物料守恒为:c(K+)=c(A-)+c(HA).
A.NaA水解,A-+H2O?HA+OH-,该混合液pH>7,故A错误;
B.HA为弱酸,部分电离,而溶剂水也电离产生氢离子,所以c(HA)>c(H+)>c(A-),故B正确;
C.HA是弱电解质,则有c(A-)>c(OH-),c(OH-)除了水解产生的还有水电离的,因此c(OH-)>c(HA),所以有:c(K+)=0.05mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即X表示OH-,Y表示HA,Z表示H+,故C错误;
D.溶液中存在物料守恒c(K+)=c(A-)+c(HA),Y表示HA,得到c(A-)+c(Y)=c(K+),故D错误;
故选B.
点评 本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,考查离子浓度大小比较、溶液PH值、盐类水解等,判断一元酸HA是弱酸为解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含共价键的共价化合物一定是分子晶体,分子晶体一定含共价键 | |
| B. | 固态可以导电的是离子晶体和金属晶体 | |
| C. | 由原子构成的晶体一定是原子晶体,由分子构成的晶体一定是分子晶体 | |
| D. | 判定晶体为离子晶体还是分子晶体的方法是看其熔融态是否能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W分别与钠形成的化合物摩尔质量相同,且每种化合物中阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为离子化合物 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com