
 工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:
工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:分析 (1)装置图分析与电源正极相连的为电解池的阳极,与电源负极相连的为电解池的阴极,阳极上是氢氧根离子失电子生成氧气;
(2)阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生.
解答 解:(1)装置图分析与电源正极相连的为电解池的阳极,与电源负极相连的为电解池的阴极,阳极上是氢氧根离子失电子生成氧气,电极反应为:4OH--4e-═2H2O+O2↑(或2H2O-4e-=4H++O2↑),生成的氢离子与HCO3-反应生成二氧化碳气体,
故答案为:4OH--4e-═2H2O+O2↑(或2H2O-4e-=4H++O2↑);
(2)在阴极区,溶液中H+放电,破坏水的电离平衡,OH-浓度增大,OH-与HCO3-反应生成CO32-,所以CO32-再生,
故答案为:HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移(或溶液中H+放电,增大了OH-浓度,与HCO3-反应,从而使CO32-再生).
点评 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,答题时注意审题,把握离子的变化以及电极方程式的书写,题目难度不大.


科目:高中化学 来源: 题型:解答题
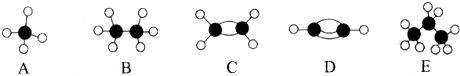
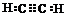 ,A的二氯取代物有1种.
,A的二氯取代物有1种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、纯碱、石英均为电解质 | D. | 氯水、水玻璃、氨水均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水显碱性:NH3•H2O═NH4++OH- | |
| B. | 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2Cl- | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、I-、SCN-、SO42- | |
| D. | 由水电离出的c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸可以干燥SO2、H2等气体 | |
| B. | 常温下浓硫酸可以使Al、Fe发生钝化 | |
| C. | 浓硫酸可以使蔗糖发生炭化 | |
| D. | 用浓硫酸和NaCl固体加热制备HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
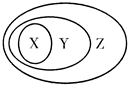
| A. | X是氧化物Y是化合物Z是纯净物 | |
| B. | X是非金属单质Y是非电解质Z是纯净物 | |
| C. | X是金属氧化物Y是碱性氧化物Z氧化物是 | |
| D. | X是置换反应Y是氧化还原反应Z是离子反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com