
| A. | 浓硫酸 | B. | 稀硝酸 | C. | 王水 | D. | 硫酸铜 |
科目:高中化学 来源: 题型:选择题
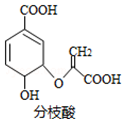
| A. | 分子中含有5种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 将表面附有黑色Ag2S的银器浸入盛有食盐水的铝质容器中,黑色逐渐褪去 | 银器为正极,Ag2S得电子生成单质银 |
| B | 测定相同浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| C | 向NaAlO2溶液中滴入NaHCO3溶液,有白色沉淀生成 | AlO2-和HCO3-的水解反应相互促进 |
| D | 将Fe(NO3)2晶体溶于稀H2SO4后,滴加KSCN溶液,溶液变红 | Fe(NO3)2晶体已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能存在核外电子排布式为1s22s22p63s23p64s24p1的原子 | |
| B. | 当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反 | |
| C. | 次氯酸的电子式:H?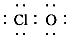 | |
| D. | 基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L氧气所含的原子数为NA | |
| B. | 2.3g金属钠变为钠离子得到0.1NA电子 | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 常温常压下32g O2与O3的混合物含有的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Fe2+和Cu2+ | B. | 一定有Fe2+、Cu2+,可能有Fe3+ | ||
| C. | 一定有Fe2+,可能有Cu2+ | D. | 只有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向100ml浓度均为1mol/LFeI2、FeBr2混合溶液中通入标况下4.48L的氯气:3Cl2+2Fe2++4I-=2I2+2Fe3++6Cl- | |
| B. | 将1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ | |
| C. | 在澄清石灰水中加入过量的Ca(HCO3)2溶液:2OH-+Ca2++2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 向NaClO溶液加入少量FeCl2溶液:2Fe2++ClO-+2H+═2Fe3++2H2O+Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com