工业废水中常含有一定量的Cr
2O
72-和CrO
42-,它们会对人类及生态系统
产生很大的伤害,必须进行处理.该法的工艺流程为CrO
4-2Cr
2O
72-Cr
3+Cr(OH)
3↓
其中第①步存在平衡:2CrO
42-(黄色)+2H
+?Cr
2O
72-(橙色)+H
2O
(1)若平衡体系的pH=2,则溶液显色.
(2)能说明第①步反应达平衡状态的是
.(选填编号)
a.Cr
2O
72-和CrO
42-的浓度相同 b.v
正 (Cr
2O
72-)=2v
逆(CrO
42-)
c.溶液的颜色不变d.溶液的pH值不变
(3)写出第②步中Cr
2O
72-转变为Cr
3+的离子方程式:
.
(4)向Cr
2(SO
4)
3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)
3沉淀,随着pH的-H
2O
升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)
4]
-离子.其平衡关系如
+H
2O下:H
++[Cr(OH)
4]
-(亮绿色)?Cr(OH)
3(s,灰绿色)?Cr
3+(紫色)+3OH
-.
现向0.05mol?L
-1的Cr
2(SO
4)
3溶液50mL中,加入等体积0.6mol?L
-1的NaOH溶液,充分反应后,溶液中可观察到的现象为
,溶液中离子浓度由大到小的顺序为
.
(5)在Na[Cr(OH)
4]和Na
2Cr
2O
7混合后的溶液中加入H
2SO
4酸化,铬元素以
形式存在(填写离子符号).



 阅读快车系列答案
阅读快车系列答案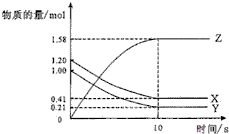 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述错误的是( )
 利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知: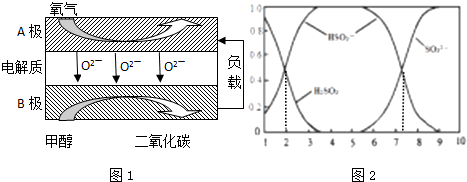
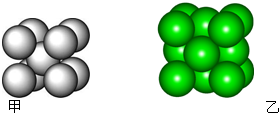 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
