
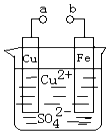
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-═Fe3+ | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| D. | a和b用导线连接后,铁片上发生还原反应,溶液中铜离子向铜电极移动 |
分析 A.a和b不连接时,铁发生化学腐蚀;
B.a和b用导线连接时,该装置构成原电池,铁作负极,铜作正极,正极上铜离子得电子发生还原反应;
C.无论a和b是否连接,铁片均会溶解,都生成亚铁离子;
D.电解池中,阳离子向阴极移动.
解答 解:A.a和b不连接时,铁和铜离子发生置换反应而发生化学腐蚀,故A正确;
B.a和b用导线连接时,该装置构成原电池,铁作负极,失电子发生氧化反应,电极反应为:Fe-2e-═Fe2+,铜作正极,正极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-═Cu,故B错误;
C.无论a和b是否连接,铁片均会溶解,都生成亚铁离子,溶液由蓝色变为浅绿色,故C正确;
D.电解池中,阳离子向阴极移动,a连接直流电流正极而作阳极,b连接直流电流负极而作阴极,电压足够大时,Cu2+向阴极铁电极移动,故D错误;
故选AC.
点评 本题考查了原电池和电解池原理,明确离子的颜色、电极上发生的反应即可解答,易错选项是B,注意铁发生电化学腐蚀生成亚铁离子而不是铁离子,题目难度中等.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 此反应不属于化学变化 | |
| B. | 112 号元素的相对原子质量为 227 | |
| C. | 科学家合成的 112 号元素的原子的中子数为 165 | |
| D. | 112 号元素属于第七周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
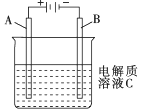 (1)肼(N2H4)又称联氨,是一种可燃性液体,可用作燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,反应生成一种可以参与大气循环的气体.该电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑.
(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,反应生成一种可以参与大气循环的气体.该电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
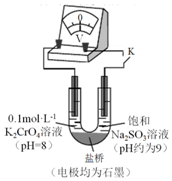 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:| 序号 | 操作 | 现象 |
| i | 向2mL pH=2的0.05mol•L-1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH 约为 9)3滴 | 溶液变绿色(含Cr3+) |
| ii | 向2mL pH=8的0.1mol•L-1 K2CrO4黄色溶液中 滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
| 序号 | 操作 | 现象 |
| iii | 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中 | |
| B. | 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出 | |
| C. | NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热 | |
| D. | 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
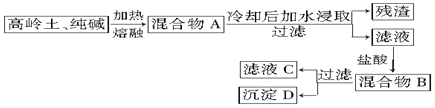
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.56L 1.8g | B. | 1.12L 3.6g | C. | 2.24L 1.8g | D. | 2.24L 3.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com