
运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填序号)。
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加少量NaOH固体,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)氯气在工业上有着极其广泛的用途。工业上通过氯碱工业生产氯气,其反应的离子方程式为____________________________。室温下,用惰性电极电解100 mL饱和食盐水,当阴极产生标准状况下11.2 mL气体,忽略溶液体积的变化时,所得溶液的pH=__________。
(3)常温下,已知25 ℃时有关弱酸的电离常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________________________________________________________________________。
若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因________________________________________________________________________
________________________________________________________________________。
(4)服用含碘化钾的碘药片可抗核辐射。将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色。完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):______+______+______—→______HIO3+______。
答案 (1)aef
(2)2Cl-+2H2O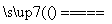 2OH-+Cl2↑+H2↑ 12
2OH-+Cl2↑+H2↑ 12
(3)NaClO+CO2+H2O===HClO+NaHCO3、
2HClO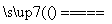 2HCl+O2↑
2HCl+O2↑
ClO-+Cl-+2H+===Cl2↑+H2O
(4)5Cl2+I2+6H2O===2HIO3+10HCl
解析 (1)氯水中存在HClO和H2O的电离平衡。SO2+Cl2+2H2O===H2SO4+2HCl,向氯水中通入SO2,其漂白性减弱。HClO是弱电解质,向氯水中通入氯气,c(H+)/c(ClO-)增大。当c(H+)=c(OH-)时离子浓度关系能满足f选项。(2)根据电解饱和食盐水的化学方程式知,产生11.2 mL H2时会产生0.001 mol OH-,忽略溶液体积的变化时,所得溶液的pH=12。
(3)NaClO可与空气中的水、CO2反应,由电离常数判断产物应是NaHCO3;消毒液与洁厕剂(含有浓盐酸)混合使用引起中毒是由于产生了Cl2。(4)氯水中的Cl2可将碘化钾中的碘置换出来,淀粉遇碘呈蓝色,继续滴加氯水,碘与Cl2进一步发生反应,碘被氧化,溶液褪为无色。


科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
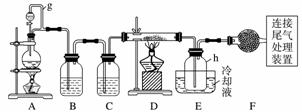
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:________________________________________________________________________。
(2)装置A中g管的作用是____________;装置C中的试剂是__________;装置E中的h瓶需要冷却的理由是_______________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是______________________(填写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立刻产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因:________________________________________________________________________
________________________________________________________________________。
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份________________________________________________________________________;
第二份________________________________________________________________________。
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为(写化学式)__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为________________________________________________________________________。
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。
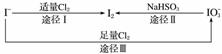
下列说法中不正确的是( )
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O===2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO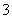
D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
当氢原子的一个电子从第二能级跃迁到第一能级时,发射的光子的波长是121.6 nm,电子从第三能级跃迁到第二能级时发射出光子的波长为656.3 nm。试回答:
(1)哪种光子的能量大,说明理由。
(2)求氢原子中电子第三能级和第二能级的能量差及第二能级和第一能级的能量差。并说明原子中的能量是否连续。
查看答案和解析>>
科目:高中化学 来源: 题型:
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶于水的白色固体,E则易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
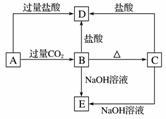
(1)写出化学式:A________,B________,C________,D________,E________。
(2)写出下列反应的离子方程式:
A→B:________________________________________________________________________;
A→D:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com