

 若把①试管中的生成物倒人水中发现溶液变蓝
若把①试管中的生成物倒人水中发现溶液变蓝科目:高中化学 来源:不详 题型:实验题
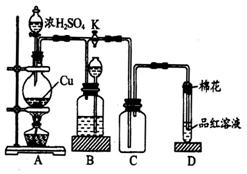
 到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.小于0.9 mol | B.等于0.9 mol | C.在0.9 mol到1.8 mol之间 | D.大于1.8 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
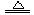 CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 6CaSiO3+P4O10 10C+P4O10
6CaSiO3+P4O10 10C+P4O10 P4+10CO
P4+10CO C6H6O6+2H++2I- 2
C6H6O6+2H++2I- 2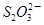 +I2
+I2
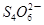 +2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
+2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。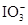 +5
+5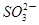 +2H+
+2H+ I2+5
I2+5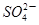 +H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示: 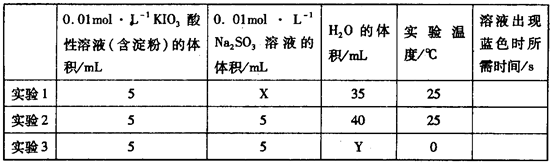
 Ce3++
Ce3++ H2O2+
H2O2+ H2O
H2O
 Ce(OH)4↓+
Ce(OH)4↓+ ______________
______________查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 反应类型属于 反应。
反应类型属于 反应。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.具有吸水性,可做干燥剂 |
| B.可用作氧化剂 |
| C.其钡盐难溶于水 |
| D.能与浓盐酸按一定比例混合,所得的混合酸可溶解铂和金 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com