
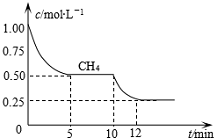
分析 0-5min时甲烷平均反应速率=$\frac{1-0.50}{5-0}$mol/(L.min)=0.1mol/(L.min),再根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算氢气反应速率,10min改变条件时甲烷的物质的量浓度不变,但随着时间的延长,甲烷浓度降低,说明不是通过改变压强或甲烷浓度而发生的平衡移动,且平衡正向移动,10-12min时甲烷的平均反应速率=$\frac{0.50-0.25}{12-10}$mol/(L.min)=0.125mol/(L.min)>0.1mol/(L.min),改变的条件是温度,据此分析解答.
解答 解:0-5min时甲烷平均反应速率=$\frac{1-0.50}{5-0}$mol/(L.min)=0.1mol/(L.min),同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比,则氢气的平均反应速率=3v(CH4)=0.3mol/(L.min),10min改变条件时甲烷的物质的量浓度不变,但随着时间的延长,甲烷浓度降低,说明不是通过改变压强或甲烷浓度而发生的平衡移动,且平衡正向移动,10-12min时甲烷的平均反应速率=$\frac{0.50-0.25}{12-10}$mol/(L.min)=0.125mol/(L.min)>0.1mol/(L.min),改变的条件是温度,该反应的正反应是吸热反应,所以改变的条件是升高温度,
故答案为:0.3;升高温度.
点评 本题考查图象分析计算有关计算,为高频考点,侧重考查学生分析判断及计算能力,明确外界条件对化学反应速率、化学平衡移动影响原理是解本题关键,知道化学反应速率与计量数之间的关系,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:推断题
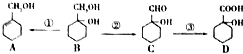 已知有机物A、B、C、D在一定条件下有如图所示的转化关系:
已知有机物A、B、C、D在一定条件下有如图所示的转化关系: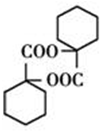 、
、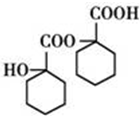 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①③④ | B. | ①③④② | C. | ④③①② | D. | ③④②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
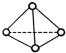 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断梨1mol N-N键吸收946kJ热量,则下列叙述中正确的是( )| A. | 1molN4气体转化为N2时要吸收206 kJ能量 | |
| B. | N4是一种比N2更稳定的分子 | |
| C. | 1molN4气体转化为N2时要放出740 kJ能量 | |
| D. | N4是N2的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com