
| A. | 常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA | |
| B. | 标准状况下,22.4L四氯化碳中所含有的Cl原子数目为4NA | |
| C. | 标准状况下,22.4升H2O中所含分子数大于NA | |
| D. | 常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA |
分析 A.依据n=$\frac{m}{M}$计算物质的量,结合有机物C2H6O存在同分异构体分析;
B.标准状况,四氯化碳不是气体,不能使用标况下的气体摩尔体积计算;
C.标况下水为液体,其摩尔体积小于22.4L/mol;
D.常温常压下,33.6L氯气物质的量小于1.5mol,56g铁为1mol,2Fe+3Cl2=2FeCl3,依据化学方程式定量关系分析,铁过量,电子转移依据反应的氯气计算.
解答 解:A.46gC2H6O的物质的量为:$\frac{46g}{46g/mol}$=1mol,有机物C2H6O存在同分异构体,若为乙醇含有极性键的数目为7NA,若为甲醚含有极性键的数目为8NA,故A错误;
B.标准状况,四氯化碳不是气体,不能使用标况下的气体摩尔体积计算22.4L四氯化碳物质的量,故B错误;
C.标况下水为液体,其摩尔体积小于22.4L/mol,则22.4L水的体积一定大于1mol,所含分子数大于NA,故C正确;
D.常温常压下,33.6L氯气物质的量小于1.5mol,56g铁为1mol,2Fe+3Cl2=2FeCl3,依据化学方程式定量关系分析,铁过量,电子转移依据反应的氯气计算转移的电子数小于3NA,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意分子式C2H6O可能为乙醇或二甲醚,注意气体摩尔体积的使用对象.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | A极上有红色固体析出 | 不能说明锌的金属性比铜强 |
| A. |  | B. | 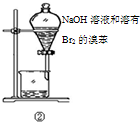 | C. | 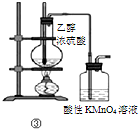 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 将氯化铁饱和溶液煮沸,以制取氢氧化铁胶体 | |
| C. | 某无色溶液中加入足量稀盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成,则原溶液中一定含有SO42- | |
| D. | 用无锈铁丝蘸取某溶液在酒精灯上灼烧,火焰呈黄色,则说明该溶液中一定不含钾离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5mL0.02mol/L的H2SO4溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 | |
| B. | 将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合,混合液pH大于7,则反应后的混合液中:c(OH-)+c(A-)>c(H+)+c(HA) | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | 常温下,0.1mol/L的CH3COONa和NaClO的混合溶液中:c(OH-)-c(H+)=c(HClO)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6a g | B. | (a-3.2)g | C. | (a-1.6)g | D. | 1.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Y2-的还原性大于Z? | B. | 单质的还原性Z>Y | ||
| C. | b一定小于c | D. | X、Y可处于同周期或X在Y的下周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
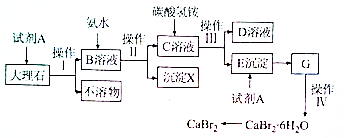
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向沸水中滴加饱和氯化铁溶液,可以制备氢氧化铁胶体,有净水的功能 | |
| B. | 容量瓶、滴定管使用前均需要检漏,并需要润洗以减小实验误差 | |
| C. | 甲烷中混有的少量乙烯可以通过溴水洗涤净化 | |
| D. | 分离乙酸乙酯和乙酸混合液时,先加入一定量的氢氧化钠溶液,生成乙酸钠后进行蒸馏,然后在乙酸钠溶液中加入足量的硫酸再蒸馏可得乙酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com