
分析 (1)n(Cu)=$\frac{32.0g}{64g/mol}$=0.5mol,n(气体)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
设NO和NO2的物质的量分别为x、y,结合原子、电子守恒可知,
$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=0.5×2}\end{array}\right.$,解得x=y=0.25mol,再结合V=nVm计算;
(2)向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH),根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO),再根据c=$\frac{n}{V}$计算.
解答 解:(1)n(Cu)=$\frac{32.0g}{64g/mol}$=0.5mol,n(气体)=$\frac{11.2L}{22.4L/mol}$=0.5mol,
设NO和NO2的物质的量分别为x、y,结合原子、电子守恒可知,
$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=0.5×2}\end{array}\right.$,解得x=y=0.25mol;
故NO的体积为0.25mol×22.4L/mol=5.6L,
NO2的体积为0.25mol×22.4L/mol=5.6L,
故答案为:5.6;5.6;
(2)向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH)=V×10-3L×amol/L根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2、NO)=0.001Vamol+0.5mol=1mol,故原有硝酸的物质的量浓度为$\frac{0.001Va+0.5}{0.1}$mol/L,
故答案为:$\frac{0.001Va+0.5}{0.1}$mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及原子、电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
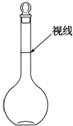 实验室配制480mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制480mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶洗净后还留有蒸馏水 | |
| B. | 取碱液的滴定管开始有气泡,放出液体后气泡消失 | |
| C. | 溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液无变化 | |
| D. | 用碱式滴定管取一定体积的NaOH溶液时,量取前仰视读数,量取后俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “沙尘暴”属于一种自然现象,与人类活动无关 | |
| B. | 碳酸铝是一种应用很广的视频添加剂,可大量添加到馒头、面包、油条等食品中 | |
| C. | 利用垃圾发电能达到节能减排的目的 | |
| D. | 持续高温天气的出现与人类活动无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由苯硝化制硝基苯;由乙醇氧化制乙醛 | |
| C. | 由乙酸和乙醇制乙酸乙酯;由乙酸乙酯水解制乙醇 | |
| D. | 由氯代乙烷制乙烯;由丙烯制1,2-二溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气混合后光照发生反应 | B. | 乙炔和氯气的加成反应 | ||
| C. | 甲苯与等物质的量的Br2发生反应 | D. | 乙烯与水的加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物CH2Cl-CH2Cl用系统命名法命名为:二氯乙烷 | |
| B. | 1mol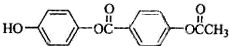 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol | |
| C. | 标准状况下,22.4L己烷所含分子数为NA | |
| D. | 乙醇与乙酸发生酯化反应时,乙醇分子中的碳氧键没断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
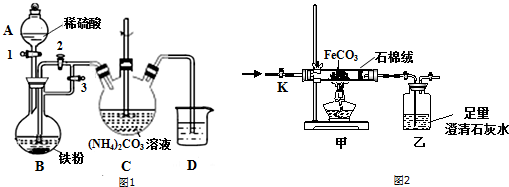
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com