

���� ��ȡ��������ˮFeCl3��ʵ������Ũ�����MnO2������ȡCl2����ΪҪ��ȡ���������FeCl3���������ɵ�Cl2�����Ǹ�������ģ�Ũ���ᡢˮ�����лӷ��ԣ��������ɵ�Cl2�к���HCl��H2O���ñ���ʳ��ˮ��ȥHCl����Ũ�������Cl2��B��������Fe��Ӧ�Ʊ��Ȼ����������ж�������ֱ���ſգ�Ӧ���ü�Һ����Cl2��
��1����ͼ��֪ʵ�����������ƣ�ʵ������Ũ�����MnO2������ȡCl2�����߷�Ӧ�����Ȼ��̡�������ˮ��
��2��װ��E������������HCl��װ��C�������Ǹ������壻
��3��װ��D����β����B���Ʊ��Ȼ�����
��4����װ�õ���ȷ����˳��Ϊ�����Ʊ�װ�á�ϴ��װ�á�����װ�á��Ȼ����Ʊ�װ�á�β������װ�ã�
��5��װ��A�У������Ӧ�������������Ϊ2.24L����״�����������ʵ���=$\frac{2.24L}{22.4L/mol}$=0.1mol����Ϸ�Ӧ�����
��� �⣺��1��ͼ�Т�ΪԲ����ƿ��ʢ��Ũ�����ʵ�������ڵ�����Ϊ��Һ©����ʵ������Ũ�����MnO2������ȡCl2�����߷�Ӧ�����Ȼ��̡�������ˮ����Ӧ����ʽΪMnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
�ʴ�Ϊ��Բ����ƿ����Һ©����MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
��2��װ��E�����������ջӷ�����HCl��װ��C�������Ǹ������壬��ֹ�ò���������Ȼ�����
�ʴ�Ϊ����ȥ�����е��Ȼ��⣻����������
��3��װ��D������Ϊ����β����������ӦΪCl2+2NaOH=NaCl+NaClO+H2O��װ��B�з�Ӧ�Ļ�ѧ����ʽΪ2Fe+3Cl2$\frac{\underline{\;����\;}}{\;}$2FeCl3��
�ʴ�Ϊ������β����Cl2+2NaOH=NaCl+NaClO+H2O��2Fe+3Cl2$\frac{\underline{\;����\;}}{\;}$2FeCl3��
��4����װ�õ���ȷ����˳��Ϊ�����Ʊ�װ�á�ϴ��װ�á�����װ�á��Ȼ����Ʊ�װ�á�β������װ�ã�����������˳����a��g��h��d��e��b��c��f��
�ʴ�Ϊ��g��h��d��e��b��c��f��
��5��װ��A�У������Ӧ�������������Ϊ2.24L����״�����������ʵ���=$\frac{2.24L}{22.4L/mol}$=0.1mol����MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��֪������HClΪ0.4mol���ʴ�Ϊ��0.4mol��
���� ���⿼�����ʵ��Ʊ�ʵ�飬Ϊ��Ƶ���㣬�����Ʊ�ʵ��װ�á�ʵ��ԭ�������������ӡ����ʵ����ʼ������ķ�ӦΪ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��Ԫ�ػ�����֪ʶ��ʵ��Ľ�ϣ���Ŀ�ѶȲ���


 �������Ӳ�ϵ�д�
�������Ӳ�ϵ�д� ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� ��
�� +
+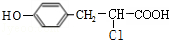 $��_{��}^{����}$
$��_{��}^{����}$ +HCl��
+HCl���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������Ȼ�����Ƶ���H2��CO��Ϊ��Ҫ��ɵĹ�ҵԭ�Ϻϳ�������ӦΪCH4��g��+H2O��g��?CO��g��+3H2��g����
������Ȼ�����Ƶ���H2��CO��Ϊ��Ҫ��ɵĹ�ҵԭ�Ϻϳ�������ӦΪCH4��g��+H2O��g��?CO��g��+3H2��g�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 +CH2�TCH-M$��_{��}^{Pb}$
+CH2�TCH-M$��_{��}^{Pb}$ =CH-M+HX��XΪ±ԭ�ӣ�MΪ������������ȡ�����ȣ������л���A�ϳ�G���㶹�أ��IJ������£�
=CH-M+HX��XΪ±ԭ�ӣ�MΪ������������ȡ�����ȣ������л���A�ϳ�G���㶹�أ��IJ������£�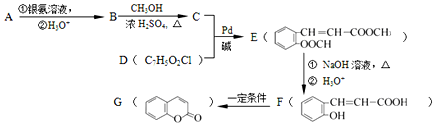
 ��
�� ������2�֣�
������2�֣� ��·������ͼ��
��·������ͼ�� ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com