
【题目】下列说法正确的是
A. 碘化钾溶液遇淀粉变蓝
B. 油脂在酸性条件下的水解反应,也称皂化反应
C. 苯在溴化铁的催化下能与溴水反应
D. 加热时葡萄糖能与新制氢氧化铜反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在298 K、100 kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1 Cl2(g)+H2(g)=2HCl(g) ΔH2 2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1-2ΔH2B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1+2ΔH2D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)分析有机物的结构,有助于对其性质的掌握.
①有机物(CH3)3CCH2OH的名称为(填字母)
a.2,2﹣二甲基﹣1﹣丙醇 b.2,2,2﹣三甲基﹣2﹣乙醇 c.2,2﹣二甲基﹣2﹣丁醇
②下列化合物中不能使酸性高锰酸钾溶液褪色的是(填字母)
a、 ![]() ;b.CH≡CCH3; c、
;b.CH≡CCH3; c、 ![]()
③欲区分 ![]() 和
和 ![]() ,可选用(填字母)
,可选用(填字母)
a.AgNO3溶液 b.溴水 c.FeCl3溶液
(2)丹参素分子能抑制血小板的聚集,其结构简式为 ![]()
①丹参素分子中共平面的碳原子最少是个.
②1mol丹参素在一定条件下最多能与mol H2发生加成反应.
③丹参素的一种同分异构体( 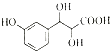 )与足量溴水反应所得产物的结构简式为
)与足量溴水反应所得产物的结构简式为
(3)下面是某有机物中间体的部分合成路线: 
①A中含氧官能团的名称为和 .
②A与NaOH溶液在加热条件下发生反应后,有机产物的结构简式为
③B→C反应的类型为;该反应还可能产生另一种芳香族化合物(副产物),其结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法错误的是( )
A. 标准状态下,1LSO3含有的分子数为NA/22.4
B. 17gOH-中含有的电子数为10NA
C. 46g二氧化氮和46g四氧化二氮含有的原子数均为3NA
D. 常温常压下,34gH2O2中含有共用电子对数为3NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】形成蛋白质分子结构的层次,从小到大依次是( )
①氨基酸 ②C、H、O、N等元素 ③氨基酸脱水缩合 ④一条或几条多肽链连接在一起 ⑤多肽 ⑥蛋白质
A. ②→①→③→④→⑥→⑤
B. ①→②→③→④→⑥→⑤
C. ②→①→⑥→③→④→⑤
D. ②→①→③→⑤→④→⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①NaHCO3溶液加水稀释时,![]() 将增大;
将增大;
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO![]() )+c(HCO)];
)+c(HCO)];
③在0.1 mol·L-1氨水中滴加0.1 mol·L-1盐酸,恰好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1;
④已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2Cr2O4的溶解度小于AgCl
A. ①② B. ②④ C. ① D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、用0.1 molL-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 molL-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
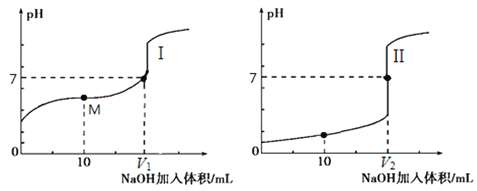
①滴定盐酸的曲线是______________(填“I”或“Ⅱ”);
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____________________;
③V1和V2的关系:V1 _____ V2(填“>”、“=”或“<”)。
Ⅱ、已知25℃时,2.0×103 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F)与溶液pH的变化关系如图所示。

(1)25℃时,HF的电离平衡常数Ka=_____________。
(2)已知HF(aq)![]() H+(aq)+F(aq) ΔH=10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
H+(aq)+F(aq) ΔH=10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
a.Ka b.Kw c.n(H+) d. 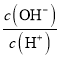
(3)25℃时,在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是__________________。
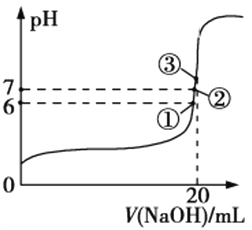
a.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
b.①点时pH=6,此时溶液中,c(F)c(Na+)=9.9×107 mol/L
c.②点时,溶液中的c(F)=c(Na+)
d.③点时V=20 mL,此时溶液中c(F)<c(Na+)=0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3* | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时 的pH | 1.9 | 7.0 | — | 一 | — |
沉淀完全时 的pH | 3.2 | 9.0 | 11.1 | 8 | 9 (>9溶解) |
(1)实验室用98% (密度为1.84 g·cm-3)的浓硫酸配制200mL4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒外,还需__________________________________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏小的操作是____________________(填序号)
a.定容时俯视刻度线 b.量取浓硫酸时,俯视刻度线
c.当容置瓶中液体占容积2/3左右时,未振荡摇匀 d.转移溶液时,没有等溶液冷却至室温
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是_____________________________。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是___________________。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn +nNa+,被交换的杂质离子是_____________________。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平)
____________________________________________________________Na2SO4.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com