
【题目】氮可以形成多种离子,如N3-、N3-、NH2-、NH4+、N2H5+、N2H62+ 等,已知H2O结合一个H+可得到H3O+,N2H5+与N2H62+是由中性分子X结合H+形成的,有类似于NH4+的性质。
⑴ 形成N2H5+离子的中性分子X的结构式是______________;
⑵ X在氧气中可以燃烧,写出燃烧反应的化学方程式_______________________________;
⑶ 写出N2H62+离子在足量强碱溶液中反应的离子方程式________________________________。
【答案】![]() N2H4+O2
N2H4+O2![]() N2+2H2O N2H62++2OH-=N2H4+2H2O
N2+2H2O N2H62++2OH-=N2H4+2H2O
【解析】
(1)依据氨气与氢离子结合生成铵根类推X;
(2)N2H4在氧气中可以燃烧生成氮气和水;
(3)依据铵根与氢氧根的反应类推。
(1)N2H62+是由中性分子X结合H+形成的,有类似于NH4+的性质,由于带2个正电荷,说明该分子结合了2个质子,去掉质子即是该分子,则该分子为N2H4,X的结构式是![]() ;
;
(2)N2H4在氧气中可以燃烧生成氮气和水,其反应方程式为N2H4+O2![]() N2+2H2O;
N2+2H2O;
(3)N2H62+是由中性分子N2H4结合2个质子形成的,故N2H62+相当于二元酸,因此碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | NaOH | Na2CO3 | NaHCO3 | ②通入适量CO2 | |
C. | Cu | CuSO4 | Cu(OH)2 | ③加热 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5 次氯酸 K=2.95×10-8
碳酸 K1=4.0×10-7 K2=5.0×10-11
亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)常温下,写出碳酸的第一级电离平衡常数表达式K1=__________,则0.50mol/L的Na2CO3溶液的pH=________
(2)等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为_____________。
(3)向0.01molL-1CH3COONa溶液中分别加入少量浓盐酸、Na2CO3固体使水解平衡移动的方向分别为___________、________.(填“左”“右”或“不移动”)
(4)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合混合液中的下列关系式正确的是________。
A.c(CH3COOH)+2c(OH-)=c(CH3COO-)+2c(H+)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.2mol/L
D. c(CH3COOH) > c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
(5)下列离子方程式中错误的是________。
A.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO![]() +HClO
+HClO
B.少量SO2通入次氯酸钙溶液中:2ClO-+SO2+H2O===SO32-+2HClO
C.Na2CO3溶液中加入足量NaHSO3溶液: CO32-+HSO3-=HCO3-+SO32-
D.少量CO2通入亚硫酸钠溶液中: SO32-+CO2+H2O=HSO3-+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。已知稀HNO3具有强氧化性。下列说法不正确的是( )

A. SO42-、SO32-至少含有一种 B. 沉淀B的化学式为 BaCO3
C. 肯定存在的阴离子有 CO32-、HCO3-、Cl- D. Br—肯定不存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______。
(4)A、C、D、E的原子半径由大到小的顺序是_______(用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______于F(填“强”或“弱”),并用化学方程式证明上述结论_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是一种合成药物的中间体,H的合成方案如下:

已知: ![]()
请回答下列问题:
(1)A为相对分子质量为104的芳香烃,A的实验式为___________
(2)可鉴别A和C两种有机物的试剂为(答出一种即可)___________________________
(3)F为一氯代物,其核磁共振氢谱有三个吸收峰,则E的结构简式为________________
(4)写出B→C的化学方程式____________________________________________________
(5)写出D和G生成H的化学方程式_____________________________________________
(6)D的同分异构体中能与FeCl3溶液发生显色反应且能发生银镜反应的有__________种,写出其中核磁共振氢谱中吸收峰数目最少的结构简式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液中,探究Fe2+和I-的还原性强弱。
[提出假设] 假设1:Fe2+还原性比I-强。
假设2:I-还原性比Fe2+强。
[验证假设] 选择几种装置进行实验:

(1)实验必需的装置是A→____________(按Cl2气流方向的顺序填写)。
(2)实验开始后,控制通入氯气的量,当通入少量氯气时,通过观察混合溶液颜色的变化________(填“能”或“不能”)判断反应的先后顺序。
(3)请在下表中写出实验步骤及预期现象和结论________、________、________、________、_______、________。

(4)为了实验成功,必须控制各物质的量。该小组称取1.52g FeSO4固体,同时称取1.66g KI固体,溶于水中配成混合溶液。为了验证上述假设,通入的Cl2体积最多不能超过________L(标准状况)。
[思考与交流]
(5)有同学质疑,上述实验中Cl2量很难控制,无法验证Fe2+和I-反应的先后顺序。于是提出另一方案:往KI溶液中滴入________溶液,如果能发生反应,即可证明I-的还原性强于Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:
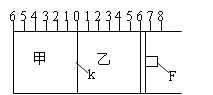
(1)可根据 _______________现象来判断甲乙都已达到平衡状态。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是___________________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为______________(带单位)
Ⅱ.若一开始就将K、F如图固定,其他条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为 _________________ ;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 ____________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com