
根据下表中提供的数据,判断在等浓度的NaF、NaHC2O4混合溶液中,各种离子浓度关系正确的是( )
|


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |


查看答案和解析>>
科目:高中化学 来源:知识精讲与能力训练 高三化学 题型:013
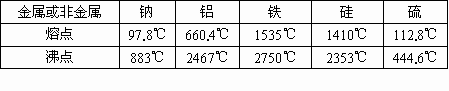
合金是不同金属或金属与一些非金属熔化状态下形成的一种熔合物,根据下表中提供的数据,判断可以形成合金的
[ ]
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省青岛九中高二(上)期末化学试卷(解析版) 题型:选择题
| 化学式 | 电离常数(Ka) |
| HF | 6.8×10-4 |
| (乙二酸) | 5.6×10-2 |
| 5.4×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com