
【题目】浓度为0.1 mol/L的HCl溶液V mL,加水稀释到2V mL,再取出10 mL,这10 mL溶液中c(H+)为
A.0.1 mol/LB.0.01 mol/LC.0.02 mol/LD.0.05 mol/L
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】某同学用滤纸折成一个纸蝴蝶,并喷洒一种溶液(保持湿润),挂在铁架台上,将盛某种溶液的烧杯放在纸蝴蝶的下方,如图所示。向烧杯中加入另一种物质,过一会儿发现纸蝴蝶变为红色且保持红色不变,下面的组合能够实现上述变化的是( )
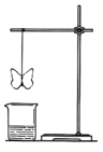
A | B | C | D | |
纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
烧杯中的溶液 | 浓硫酸 | 氯化铵 | 稀硫酸 | 高锰酸钾 |
加入烧杯中的物质 | 铜 | 氢氧化钠浓溶液 | 氨水 | 浓盐酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为18.4 mol/L的浓硫酸来配制 500 mL0.46 mol/L的稀硫酸,可供选择的仪器有:①玻璃棒②烧杯③胶头滴管④量筒⑤容量瓶⑥托盘天平⑦药匙
(1)上述仪器中,配制过程中用不到的有________。
(2)计算所需浓硫酸的体积为_________mL。
(3)在配制过程中,下列操作可引起所配溶液浓度偏高的有_________。(填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家哈伯(F. Haber, 1868-1930)发明的合成氨技术使大气中的氮气变成了生产氮肥的永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱,解决了地球上因粮食不足导致的饥饿和死亡问题。因此这位解救世界粮食危机的化学天才获得了1918年诺贝尔化学奖。现在我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g)2NH3(g)△H=________kJ/mol
(2)一定温度下,向一个恒压容器中充入N20.6mol,H20.5mol,在一定温度下进行反应:N2(g)+3H2(g) 2NH3(g),达到平衡时,N2的转化率为![]() ,此时容器的体积为1L。
,此时容器的体积为1L。
该温度时容器中平衡体系的平衡常数是______________。
(3)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法K2CO3溶液再生,其装置如图所示:
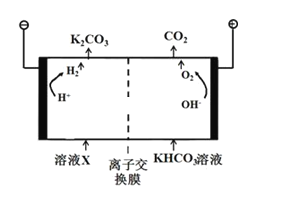
①在阳极区发生的反应包括____________________和H++HCO3- ═H2O+CO2↑。
②简述CO32-在阴极区再生的原理__________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)═2H2O(g) Δ H1═-484kJ/mol
2CH3OH(g)+ 3O2(g)═2CO2(g)+4H2O(g) Δ H2═-1352kJ/mol
写出CO2和H2生成CH3OH(g)和H2O(g)的热化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将4molA(g)和2molB(g)充入2L恒容密闭容器中,发生2A(g)+B(g) ![]() 2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
2C(g),一段时间达到平衡,反应过程中测定的数据如下表。下列说法正确的是
t/min | 2 | 4 | 8 | 9 |
n(B)/mol | 1.5 | 1.2 | 1.0 | 1.0 |
A.该温度下反应的平衡常数K=1.0
B.反应0~4 min的平均速率υ(C)=0.4 molL﹣1min﹣1
C.其他条件不变,升高温度反应的平衡常数增大,则该反应为吸热反应
D.其他条件不变,再充入4molA(g),达到新平衡时A的浓度减小,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃,向含c(H+)=0.1 molL-1、c(Cu2+ )=c(Fe3+ )=0.01 molL-1的200 mL溶液中加入NaOH固体时,c(Cu2+ )、c(Fe3+ )随pH的变化曲线如图所示(忽略加入固体时溶液体积的变化)。下列叙述不正确的是

A.Ksp[Fe(OH)3 ]<Ksp[Cu(OH)2]
B.pH=5时溶液中的阳离子主要为H+和Cu2+
C.Ksp只与难溶电解质的性质和温度有关,而与离子浓度和沉淀的量均无关
D.向含有FeCl3杂质的CuCl2溶液中加入CuO或CuCO3可除去溶液中混有的Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产生活中有广泛的应用。
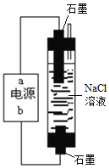
(1)一种环保型家用“84”消毒液的发生装置如右图,电源的b极为________极,电解制取NaClO的离子反应方程式为_______。
(2)用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g) ![]() COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
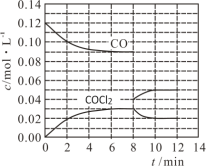
在0~6 min内υ(Cl2)=____________________,第8 min时改变的条件是________________。在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将________(填“增大”“不变”或“减小”)。
(3)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气——氯水体系中存在以下平衡关系:
![]() Cl2(g)
Cl2(g) ![]()
![]() Cl2(aq) K1=10-0.6
Cl2(aq) K1=10-0.6
Cl2(aq) + H2O![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO ![]() H+ + ClO- Ka
H+ + ClO- Ka
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
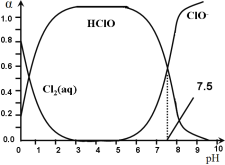
则①Ka = __________;
②Cl2(g) + H2O ![]() HClO + H+ +Cl- K = __________;
HClO + H+ +Cl- K = __________;
③用氯处理饮用水时,pH=6.5时杀菌效果比pH=7.5时___(填“好”、“差”或“相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2==2Fe(SCN)3、Ag++CN-== AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2= 2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (SCN)2+H2O = 2H++SCN-+SCNO-
D. MnO2+4HSCN(浓)![]() (SCN)2↑+Mn(SCN)2+2H2O
(SCN)2↑+Mn(SCN)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是
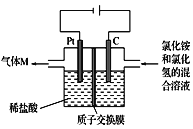
A.每生成1 mol NCl3,理论上有4 mol H+经质子交换膜从右侧向左侧迁移
B.石墨极的电极反应式为NH4++3Cl--6e-==NCl3+4H+
C.可用湿润的淀粉-KI试纸检验气体M
D.电解过程中,质子交换膜右侧溶液的pH会减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com