
| A. | 合金的性质与其成分金属的性质不完全相同 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 黑色的氧化铜灼烧会变成砖红色 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
分析 A.合金的性质与组分金属的化学性质相同;
B.工业上金属Mg用电解熔融的氯化物制得,氯化铝为共价化合物,工业上金属铝是用电解氧化铝来冶炼;
C.黑色的氧化铜灼烧生成氧化亚铜;
D.Cu2(OH)2CO3能溶于盐酸.
解答 解:A.合金的性质与组分金属的化学性质相同,但物理性质不同,故A正确;
B.工业上用电解氯化镁的方法生产金属镁,MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.氯化铝为共价化合物,工业上电解熔融的氧化铝制铝,反应的化学方程式为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,故B错误;
C、黑色的氧化铜灼烧生成砖红色的氧化亚铜,所以黑色的氧化铜灼烧会变成砖红色,故C正确;
D.Cu2(OH)2CO3能溶于盐酸,所以能用盐酸除去铜绿,故D正确;
故选B.
点评 本题考查金属的冶炼和合金的知识,题目难度不大,注意金属的冶炼与金属的活泼性有关.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,CH3COONH4溶液的pH=7,说明等温等浓度的CH3COOH和NH3•H2O的电离度相等 | |
| B. | 锅炉中沉积的CaSO4可用稀Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| C. | 向0.1 mol/L的Na2CO3溶液中滴加稀盐酸至中性,溶液中c(CO32-)=c(HCO3-) | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
将溶质的质量分数为a%、物质的量浓度为c1 mol·L-1的稀硫酸加热蒸发掉一定量的水,使溶质的质量分数变为2a%,此时硫酸的物质的量浓度为c2 mol·L-1,则c1和c2的关系是( )
A.c2=2c1 B.c2>2c1 C.c2<2cl D.c1=2c2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molH2、2molN2 | 4molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| N2的体积分数 | w 1 | w 2 | w 3 |
| 混合气体的密度(g•L-1) | ?ρ1 | ?ρ2 | ?ρ3? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答:
如图,将4mol SO2和2mol O2混合气体置于恒压密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.该反应达到平衡状态时,测得气体的总物质的量为4.2mol.回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
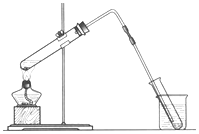
 磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 3mol•L-1Na2S2O3的溶液 | B. | 20mL 2mol•L-1Na2S2O3的溶液 | ||
| C. | 10mL 4mol•L-1Na2S2O3的溶液 | D. | 10mL 2mol•L-1Na2S2O3的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 | Na2CO3 | NaOH | BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com