
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 8.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.38 |
分析 (1)盛酸用酸式滴定管;
(2)滴定过程中,眼睛注视着锥形瓶内溶液颜色的变化,滴定终点判断,酚酞作指示剂,溶液颜色由浅红色变为无色时,且半分钟颜色不变化;
(3)先检查容量瓶是否漏水,再分别用蒸馏水洗酸式滴定管、碱式滴定管,再润洗,再装液,最后滴定;
(4)算出三次消耗盐酸的体积,求出平均值,再计算出待测液的浓度;
(5)滴定前平视读数,滴定终点时俯视,俯视读数偏小.
解答 解:(1)滴定操作中,酸或者强氧化性物质要用酸式滴定管盛,碱用碱式滴定管,
故答案为:酸式;
(2)滴定时,眼睛要注视着锥形瓶内溶液颜色的变化,避免产生较大误差;酚酞作指示剂,溶液颜色由浅红色变为无色时,且半分钟颜色不变化,
故答案为:锥形瓶内溶液颜色的变化;溶液颜色由浅红色变为无色时,且半分钟颜色不变化;
(3)先检查容量瓶是否漏水,再分别用蒸馏水洗酸式滴定管、碱式滴定管,再润洗,再装液,最后滴定,滴定操作的正确顺序是:①⑤③④②⑥,
故答案为:①⑤③④②⑥;
(4)三次消耗的盐酸的体积分别为:20.02ml、18.00ml、19.98ml,第2次无效,用第1次和第3次数据计算,平均体积为20.00ml,带入c(NaOH)=$\frac{c(HCl)×V(HCl)}{V(NaOH)}$=$\frac{0.2000mol•{L}^{-1}×0.02L}{0.02L}$=0.2000mol/L,
故答案为 0.2000mol/L;
(5)滴定前平视读数,滴定终点时俯视,俯视读数偏小,根据c(待)=$\frac{c(标)×V(标)}{V(待)}$,计算时标准液氢氧化钠体积减少,测定结果偏低,
故答案为:偏低.
点评 本题考查酸碱中和滴定,注重了中和滴定实验的操作步骤,数据处理,并用公式c(待)=$\frac{c(标)×V(标)}{V(待)}$分析误差,难度适中.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾处理水的原理与明矾完全相同 | |
| B. | 推广煤的气化和液化技术,能减少二氧化碳的排放 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料 | |
| D. | 食品安全包括限制添加剂的种类和添加的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现有一瓶标签受到腐蚀(如图所示)的无色溶液,已知该溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠、硫化钠中的一种,为确定溶液的成分,同学们进行了如下探究:
现有一瓶标签受到腐蚀(如图所示)的无色溶液,已知该溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠、硫化钠中的一种,为确定溶液的成分,同学们进行了如下探究:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向FeI2溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 将少量CO2通入NH3•H2O中:CO2+2NH3•H2O═(NH4)2CO3+H2O | |
| C. | 将少量SO2通入NH3•H2O中:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| D. | 将AlCl3与等量Na2CO3溶液混合:3H2O+Al3++CO32-═HCO3-+Al(OH)3+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
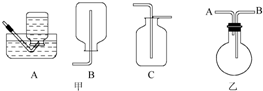
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
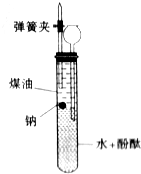 (1)等质量的O2、CH4、H2的物质的量的比值为1:2+16.
(1)等质量的O2、CH4、H2的物质的量的比值为1:2+16.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com