
| A. | HCl和HNO3放出H2一样多 | B. | 醋酸中放出H2最多 | ||
| C. | HCl中放出H2最多 | D. | HNO3比醋酸放出H2多 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用铜作电极电解NaCl溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) | |
| C. | 磷酸一氢钠溶液水解:HPO42-+H2O?PO42-+H3O+ | |
| D. | 常温下,由水电离产生的c(H+)=10-12mol•L-1的溶液,NH4+、SO42-、HCO3-、Cl-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中每个离子周围均吸引着6个带相反电荷的离子 | |
| B. | 在晶体中,若有阳离子一定存在阴离子 | |
| C. | 分子晶体中一定不含有离子键,但一定存在共价键 | |
| D. | 原子晶体中的各相邻原子都以共价键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液:称量固体时物体与砝码位置颠倒 | |
| B. | 配制一定物质的量浓度的溶液:定容时仰视刻度线 | |
| C. | 用浓硫酸与烧碱的稀溶液反应来测定中和热的数值 | |
| D. | 用10.0mL的量筒量取7.8mL浓硫酸时俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
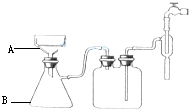 按要求完成硝酸钾晶体的制备实验:
按要求完成硝酸钾晶体的制备实验:| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① | 溶解 | 取20克KNO3和17克NaCl溶解在35ml水中,加热至沸,并不断搅拌. | 固体溶解 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩. | 有a晶体析出. |
| ③ | 热过滤 | 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为b. |
| ④ | 冷却 | 将滤液冷却至室温. | 有晶体析出. |
| ⑤ | 按有关要求进行操作 | 得到初产品硝酸钾晶体 | |
⑥ | 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤. | 得到纯度较高的硝酸钾晶体 | |
| ⑦ | 检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | NaOH | H2SO4 | BaCO3 | SO2 | CO2 |
| B | Ba(OH)2 | HCl | NaCl | Na2O | CO |
| C | Na2CO3 | CH3COOH | CaCl2 | CO2 | SO2 |
| D | KOH | HClO | CaCO3 | CaO | SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com