
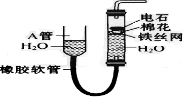
 如图中的实验装置可用于制取乙炔. 请填空:
如图中的实验装置可用于制取乙炔. 请填空: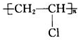 .
. 分析 (1)通过图中A管,可以控制反应的开始和停止;实验室通过电石与水的反应制取乙炔;
(2)关键乙炔与溴发生加成反应进行判断;
(3)乙炔与氯化氢发生加成反应生成氯乙烯,氯乙烯加成聚合生成聚氯乙烯.
解答 解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔能够和溴水发生加成反应,故答案为:溴的四氯化碳溶液褪色;加成;
(3)乙炔与氯化氢发生加成反应生成氯乙烯,氯乙烯加成聚合生成聚氯乙烯,化学方程式为:CH≡CH+HCl→CH2=CHCl,nCH2=CHCl$\stackrel{引发剂}{→}$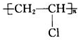 ;
;
故答案为:CH≡CH+HCl→CH2=CHCl,nCH2=CHCl$\stackrel{引发剂}{→}$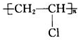 .
.
点评 本题考查乙炔的实验室制法及其性质,侧重基础知识的考查,注意基础的掌握,难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正价依次降低 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Na、K、Rb的金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
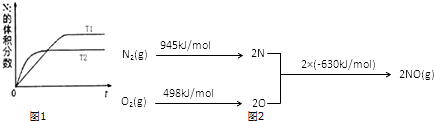
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定 次数 | 待测溶液的体积 /mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com