
| A. | 已知X、Y元素同周期,且电负性X>Y,则第一电离能X大于Y | |
| B. | 分子中键能越大,键长越短,则分子越稳定,熔沸点越高 | |
| C. | N-H键键能的含义是拆开约6.02×1023个N-H键所吸收的能量 | |
| D. | H2O中每个O原子结合2个H原子的根本原因是共价键具有方向性 |
分析 A.同周期元素从左到右元素的电负性逐渐增大,第一电离能逐渐增大但ⅤA族大于ⅥA族元素;
B.键能决定分子的稳定性,而熔沸点的高低取决于分子间作用力;
C.N-H键键能含义是拆开1mol即NA个N-H键所吸收的能量;
D.H2O中每个O原子结合2个H原子与共价键的饱和性有关.
解答 解:A.同周期元素从左到右元素的电负性逐渐增大,第一电离能呈增大趋势,但ⅤA族大于ⅥA族元素的第一电离能,故A错误;
B.键能决定分子的稳定性,如为分子晶体,则熔沸点的高低取决于分子间作用力,故B错误;
C.N-H键键能含义是拆开1mol即NA个N-H键所吸收的能量,即拆开约6.02×1023个N-H键所吸收的能量,故C正确;
D.H2O中每个O原子结合2个H原子与共价键的饱和性有关,故D错误.
故选C.
点评 本题考查元素的性质的递变规律,为高频考点,侧重于学生的分析能力的考查,题目难度不大,易错点为A,注意同周期ⅤA族大于ⅥA族元素的第一电离能.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
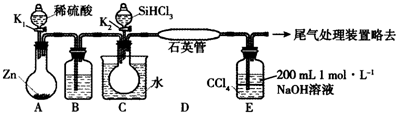
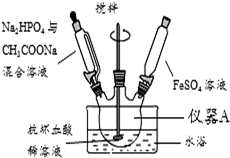 磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.
磷酸亚铁[Fe3(PO4)2•8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇.主要用于制造磷酸铁锂电池.实验室制备磷酸亚铁的装置示意图如图、反应和实验步骤如下.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
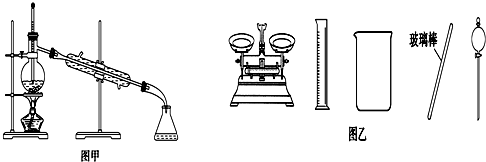
| A. | 闻未知液体气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动 | |
| B. | 将碘单质从碘的CCl4溶液中分离出来可用如图甲所示实验装置 | |
| C. | 用容量瓶配制好一定浓度的某溶液后,塞紧瓶塞并在容量瓶上贴上标签 | |
| D. | 配制500 mL 0.4 mol•L-1NaCl溶液,必要的仪器如图乙所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是:胶体粒子直径在1-100nm之间 | |
| B. | 一定温度、压强下,气体体积由其分子的大小决定 | |
| C. | 氧化还原反应的本质是电子转移 | |
| D. | 在1L2mol/L的氢氧化铁胶体中含有氢氧化铁胶粒数小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA | |
| B. | CO2通过Na2O2使其增重5.6g时,反应中转移的电子数为0.4 NA | |
| C. | 0.2mol Fe与0.2 mol Cl2反应时失电子数为0.6NA | |
| D. | 常温常压下,29.8 g KCl与NaClO的固体混合物中阴离子的数目为0.4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com