


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
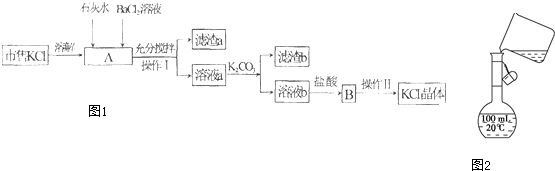
| 编号 | 实验内容 | 实验目的 |
| A | 在滴有酚酞的Na2CO3溶液中, 加入BaCl2溶液后红色褪去 | 验证Na2CO3溶液中存在水解平衡 |
| B | 在未知溶液中加入稀盐酸和氯化钡溶液有沉淀生成 | 说明该未知溶液含有SO42- |
| C | 用玻璃棒蘸取氯水点在pH是指中央 | 检验氯水呈酸性 |
| D | 将C与浓硫酸反应后的气体直接通入石灰水 | 证明反应有CO2生成 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
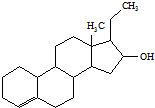 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )| A、该物质的分子式为C20H30O |
| B、该物质能与NaHCO3溶液反应 |
| C、能使溴的四氯化碳溶液褪色 |
| D、该物质分子中的所有碳原子均共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和Na2CO3(aq)中通入过量的CO2 |
| B、向饱和的食盐水中加入一小块间质钠 |
| C、向CaCl2(aq)中通入少量的CO2气体 |
| D、向AlCl3(aq)滴入过量稀氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、La和盐酸反应的离子方程式为:La+2H+=La3++H2↑ |
| B、LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3 |
| C、镧有两种核素:57139La和放射性57138La,由此可知镧元素的相对原子质量为138.5 |
| D、La(NO3)3水溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
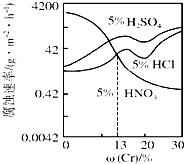
| A、稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 |
| B、随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 |
| C、Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |
| D、稀硝酸和过量铁反应的化学方程式是:Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑤①③④② |
| B、⑤②①③④ |
| C、⑤①④③② |
| D、②⑤①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 | B、3 | C、2 | D、1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com