
【题目】下列关于指定粒子构成的叙述中,不正确的是( )
A.37Cl与39K具有相同的中子数
B.![]() He和
He和 ![]() He是两种不同的核素
He是两种不同的核素
C.H3O+与OH﹣具有相同的质子数和电子数
D.O22﹣与S2﹣具有相同的质子数和电子数
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NaHSO4溶于水只需要克服离子键
B. 单质分子中都存在化学键
C. 晶体熔沸点由高到低的顺序为:金刚石>碳化硅>氯化钠
D. 干冰气化,克服了共价键和分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业品盐酸中因含有Fe3+而带黄色,若某工业品盐酸中的H+和Cl-的个数比为91:94,则该盐酸中Fe3+和Cl-的个数比为:
A.1:1B.1:3C.91:94 D.1:94
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2 , 能将H2O2氧化。为了验证某小组学生设计了如下图所示的实验装置进行实验(夹持装置略去)。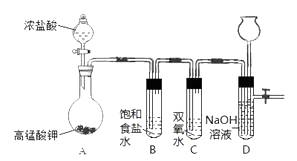
已知:2KMnO4+16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
试管B中饱和食盐水的主要作用是除去Cl2中混有的HCl
请回答下列问题。
(1)试管C发生反应的化学方程式是。
(2)试管D中NaOH溶液的作用是。
(3)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭D中止水夹,反应一段时间后试管D中的现象为 , 试管D中的气体检验方法为。
(4)有的同学对上述实验中D试管中的气体来源产生质疑,你认为可能的来源有(用方程式回答)。对于质疑可以采用对比实验来解决。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是
A. 分散质颗粒直径都在l~100nm之间 B. 都能产生丁达尔效应
C. 加入浓氢氧化钠溶液都产生红褐色沉淀 D. 颜色都呈红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲 | 乙 | 丙 | 戊 | |
① | NH3 | O2 | NO | H2O |
② | Fe | H2O | H2 | Fe2O3 |
③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
④ | Na2O2 | CO2 | O2 | Na |

A.①③
B.②③
C.②④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、﹣2 | ﹣1 | ﹣2 |
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分). 
(2)B元素处于元素周期表中周期族;
(3)在元素周期表中的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是(填化学式);
(5)C和E形成的化合物M,能使酸性高锰酸钾溶液褪色,体现了M的性.
(6)写出D与强碱溶液反应的离子方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com