
A、
| ||
B、
| ||
C、
| ||
D、
|
| wg×2A% |
| 40g/mol |
| wA |
| 2000 |
| ||
| V×10-3L |
| wA |
| 2V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

A、电解时发生反应的化学方程式为:2HCl
| ||||
| B、由NaClO2溶液制取0.6mol ClO2时,至少消耗0.1mol NCl3 | ||||
| C、将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的 NH3 | ||||
| D、溶液X的成分为NaClO3和NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40% | B、34% |
| C、28.6% | D、25.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量NH4+的溶液中:HCO3-、K+、Na+、Cl- |
| B、酚酞呈红色的溶液中:Na+、AlO2-、K+、HCO3- |
| C、含大量H+的溶液中:Na+、Cl-、NO3-、SO32- |
| D、加入Fe能放出H2的溶液中:Na+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、过量的SO2通入氨水中:NH3?H20+SO2
| ||||
B、实验室制备氯气:MnO2+4H++2Cl-
| ||||
C、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-
| ||||
D、明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有羟基的有机物一定属于醇类 |
| B、醇的命名同烃的命名一样选择最长碳链作为主链 |
| C、醇都能发生消去反应 |
| D、醇都能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
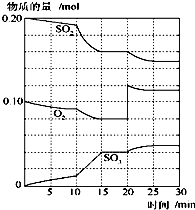 (1)在一定温度和压强下,有如下反应:2SO2(g)+O2(g) 2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L.经一段时间后,反应达到平衡,测得混合气体的密度为1.6g?L-1.请回答下列问题:
(1)在一定温度和压强下,有如下反应:2SO2(g)+O2(g) 2SO3(g),将1.6molSO2和0.8mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100L.经一段时间后,反应达到平衡,测得混合气体的密度为1.6g?L-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
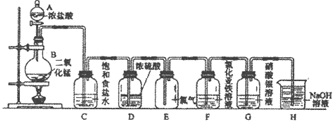
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com