
(10分) (CN)2被称为拟卤素,它的阴离子CN- 作为配体形成的配合物有重要用途。
4-1 HgCl2 和Hg(CN)2反应可制得 (CN)2, 写出反应方程式。
4-2 画出CN-、(CN)2的路易斯结构式。
4-3 写出(CN)2 (g) 在O2 (g) 中燃烧的反应方程式。
4-4 298 K下,(CN)2 (g) 的标准摩尔燃烧热为 1095 kJ mol1,C2H2 (g) 的标准摩尔燃烧热为 1300 kJ mol1,C2H2 (g) 的标准摩尔生成焓为227 kJ mol1,H2O (l) 的标准摩尔生成焓为 -286 kJ mol1,计算 (CN)2 (g) 的标准摩尔生成焓。
4-5 (CN)2在300~500 oC形成具有一维双链结构的聚合物,画出该聚合物的结构。
4-6 电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN-,写出化学方程式(漂白粉用ClO表示)。
4-1 HgCl2 和Hg(CN)2反应可制得 (CN)2, 写出反应方程式。
HgCl2 + Hg(CN)2 = Hg2Cl2 + (CN)2 (1分)
4-2 画出CN-、(CN)2的路易斯结构式。
![]()
![]() (各1分,共2分)
(各1分,共2分)
短线画成电子对同样得分;不画孤对电子不得分。
4-3 写出(CN)2 (g) 在O2 (g) 中燃烧的反应方程式。
(CN)2(g) + 2O2(g) = 2CO2(g) + N2(g) (1分)
不标物态也可。
4-4 298 K下,(CN)2 (g) 的标准摩尔燃烧热为 1095 kJ mol1,C2H2 (g) 的标准摩尔燃烧热为 1300 kJ mol1,C2H2 (g) 的标准摩尔生成焓为227 kJ mol1,H2O (l) 的标准摩尔生成焓为 -286 kJ mol1,计算 (CN)2 (g) 的标准摩尔生成焓。
(CN)2(g) + 2O2(g) = 2CO2(g) + N2(g)
2ΔfHmy(CO2)ΔfHmy[(CN)2] = 1095 kJ mol1
2ΔfHmy(CO2) = 1095 kJ mol1 +ΔfHmy[(CN)2]
C2H2(g) + 2.5O2(g) = 2CO2(g) + H2O(l)
2ΔfHmy(CO2) +ΔfHmy(H2O) ΔfHmy(C2H2) =1300 kJ mol-1
2ΔfHmy(CO2) =1300 kJ mol1 + 286kJ mol1 + 227 kJ mol1
ΔfHmy[(CN)2] = 1095 kJ mol1 1300 kJ mol1 + 286kJ mol1 + 227 kJ mol1
= 308 kJ mol1 (2分)
计算过程正确计算结果错误只得1分。没有计算过程不得分。
ΔfHmy[(CN)2] = 1095 1300 + 286 + 227 = 308(kJ mol1)也可以。
但不加括号只得1.5分。
4-5 (CN)2在300~500 oC形成具有一维双链结构的聚合物,画出该聚合物的结构。
 或
或  (2分)
(2分)
画成
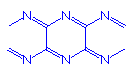 也得2分。 但画成
也得2分。 但画成 只得1分。
只得1分。
4-6 电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN-,写出化学方程式(漂白粉用ClO表示)。
2CN + 5ClO + H2O = 2HCO3 + N2 + 5Cl (2分)
产物中写成CO32只要配平,也得分。


科目:高中化学 来源: 题型:
(08年江苏卷)(10分)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN -和金属离子的配离子M(CN)nm-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
 Ag++2CN - == [Ag(CN)2] -
Ag++2CN - == [Ag(CN)2] -
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
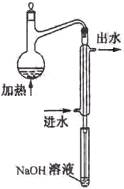
⑴水样预处理的目的是 。
⑵水样预处理的装置如右图,细导管插入吸收液中是为了 ____
⑶蒸馏瓶比吸收液面要高出很多,其目的是 。
⑷如果用盐酸代替磷酸进行预处理,实验结果将 (填“偏高”、“无影响”或“偏低”)。
⑸准确移取某工厂污水100mL,经处理后用浓度为0.01000mol?L-1的硝酸银标准溶液滴定,终点时消耗了21.00mL。此水样中含氰化合物的含量为 mg?L-1的(以计,计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2013届甘肃省张掖二中高三10月月考化学试卷(奥班)(带解析) 题型:填空题
(10分) 中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+3C+SA+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为______________________。
②在生成物中,A的晶体类型为___,含极性共价键的分子的中心原子轨道杂化类型为____。
③已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
(3)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .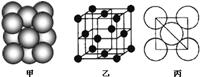
(4)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H―→Rx[CrCln(H2O)6-n]x++xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为______,中心离子的配位数为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年甘肃省高三10月月考化学试卷(奥班)(解析版) 题型:填空题
(10分) 中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+3C+SA+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为______________________。
②在生成物中,A的晶体类型为___,含极性共价键的分子的中心原子轨道杂化类型为____。
③已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
(3)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 .
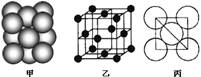
(4)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H―→Rx[CrCln(H2O)6-n]x++xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为______,中心离子的配位数为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三第一次阶段性诊断考试化学试卷 题型:填空题
(10分)黄血盐[亚铁氰化钾, ]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为
]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为 。黄血盐易溶于水,在水溶液中会电离出
。黄血盐易溶于水,在水溶液中会电离出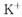 和
和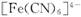 ,其中
,其中 的电子式为
的电子式为 。它与硫酸反应的化学方程式为
。它与硫酸反应的化学方程式为
(1) 上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2) 食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过400 "C1时会分解,试配平该反应的化学方程式:

(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为

①该反应的氧化产物有______(填化学式)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高一第二学期期中考试化学(实验班)试题 题型:填空题
(10分)温家宝总理多次指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 ____________________。
A.制备环氧乙烷: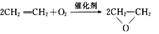
B.制备硫酸铜Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
C.制备甲醇: 2CH4+O2 2CH3OH
2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 _____________________________,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 ____________________________________________________________。
(3)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
|
|
原料生产工艺过程 |
|
乙炔 |
|
|
乙烯 |
来源于石油裂解气 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com