
����Ŀ��������ѧ֪ʶ�ش��������⣮
��1��0.5molCH4�к�����������ӣ������ӵ�������NA��ʾ�����ڱ�״���µ����Ϊ L��0.1molH2SO4�к� molHԭ�ӣ�����ˮ���100mLˮ��Һ��c��H+��= ��
��2���ڷ�Ӧ3Zn+2Fe3+�T3Zn2++2Fe�У�Fe3+�������������ԭ��������1molZn��ȫ��Ӧת�Ƶĵ�����Ϊ mol��
��3��ѡ������ʵ�鷽���������ʣ������뷽����������ں����ϣ���ѡ����
A����ȡ��Һ B������ C���ᾧ D����Һ E������ F������
�ٷ�������л��е���ɳ �� �ڷ�����ˮ�Ļ���� ��
�۷���ˮ�����͵Ļ���� �� �ܷ���ƾ���ˮ�Ļ���� ��
��4���������������ʢ�CaO��SO3��SO2��P2O5 ��HNO3��H2SO4��HCl��NaCl��KClO3��KCl��KMnO4��HgO�����о���һ����������������������ʲ�ͬ�����������ʷֱ��ǣ����������� ��
���𰸡�
��1��0.5NA��11.2��0.2��2mol/L
��2��������2
��3��F��A��D��E
��4��CaO��NaCl��HgO
���������⣺��1��0.5mol CH4�к���0.5NA��������ӣ������ӵ�������NA��ʾ�����ڱ�״���µ����Ϊ0.5mol��22.4L/mol=11.2L��0.1molH2SO4�к�0.2molHԭ�ӣ�����ˮ���100mLˮ��Һ���C��H+��= ![]() =2mol/L�����Դ��ǣ�0.5NA��11.2L��0.2��2mol/L����2���ڷ�Ӧ3Zn+2Fe3+�T3Zn2++2Fe�У�FeԪ�ػ��ϼ���+3�۽��͵�0�ۣ�Fe3+Ϊ��������ZnԪ�ػ��ϼ���0�����ߵ�+2�ۣ�1molZn��ȫ��Ӧת�Ƶĵ�����Ϊ2mol���ӣ�
=2mol/L�����Դ��ǣ�0.5NA��11.2L��0.2��2mol/L����2���ڷ�Ӧ3Zn+2Fe3+�T3Zn2++2Fe�У�FeԪ�ػ��ϼ���+3�۽��͵�0�ۣ�Fe3+Ϊ��������ZnԪ�ػ��ϼ���0�����ߵ�+2�ۣ�1molZn��ȫ��Ӧת�Ƶĵ�����Ϊ2mol���ӣ�
���Դ��ǣ�������2����3����NaCl������ˮ������ɳ���ܣ����ù��˵ķ������룬���Դ��ǣ�F���ڵ������ڱ����л��ܼ���������ȡ�ķ������룬���Դ��ǣ�A����ˮ�����ͻ������ܣ����÷�Һ�ķ������룬���Դ��ǣ�D���ܾƾ���ˮ���ܣ���������ķ������룬����ʱ�ڻ��Һ�м���CaO���ʯ�ң�Ȼ�����пɽ����߷��룬���Դ��ǣ�E����4����CaOΪ���������SO3��SO2��P2O5��Ϊ�����������HNO3��H2SO4��HCl��Ϊ�ᣬ��NaCl�����Σ���KClO3��KCl��KMnO4��Ϊ�Σ���HgO������������Դ��ǣ�CaO��NaCl��HgO��


 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ૼ����ǿ�����һ�֣���ʳƷ��ҵ������������Ҳ��Ϳ�����Ӽ���ҽҩ�����ϵ��м��壬����ૼ�ȩ�Ʊ�����ʵ��ԭ�����Ʊ��������£�
![]()
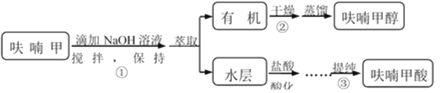
������ᴿ���̣��ܽ�������̿��ɫ�����ȹ�������ȴ�ᾧ��������ϴ�������
��֪����ૼ�����100��������133�����ڣ�230-232�����ڣ����ڴ��¶������ȣ�
��е�Ϊ31-32����������ˮ��
����ˮ�Ȼ������봼�γɸ����
��1������ٵĹؼ��ǿ����¶������ʩ�У�����������______��______��
��2��������и�����ʹ�õĸ������ѡ��______��
A��98%Ũ���� B����ˮ����þ
C����ˮ̼���� D����ˮ�Ȼ���
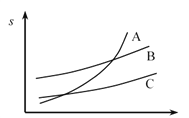
��3��ૼ�����A��B��C�����ܼ����ܽ�ȣ�s�����¶ȱ仯��������ͼ��������ᴿʱ�����ʵ��ܽ��ܼ���______��������______��
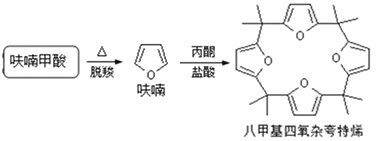
��4������ૼ��������ȡ�˼������ӿ���ϩ��
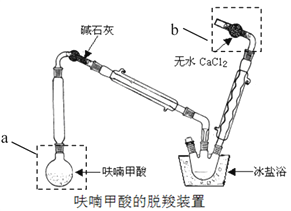
������a������:______��װ��b�����ã�______��
������װ�����ñ���ԡ��Ŀ����______��
��ȷ����ƷΪ�˼������ӿ���ϩ����ͨ���ⶨ�е㣬���ɲ��õļ�ⷽ����______��
������4.5gૼ����Ƶ���0.5g�˼������ӿ���ϩ��M=432g��mol-1���������Ϊ______������4λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10mLŨ��Ϊ2mol/LH NO3��3mol/LH2SO4�Ļ����Һ�м���1.92��ͭ����ַ�Ӧ������Һ�����Ϊ10mL����
��1�������������ڱ�״���µ����Ϊ��������
��2����Ӧ����Һ�и����ʵ�����Ũ���Ƕ��٣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.![]() ��һ������
��һ������ ![]() ��һ����ﶼ��4�֣������������칹��
��һ����ﶼ��4�֣������������칹��
B.CH3CH=CHCH3�����е��ĸ�̼ԭ����ͬһֱ����
C.��ϵͳ�������������� 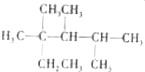 ��������2��3��4��������2���һ�����
��������2��3��4��������2���һ�����
D.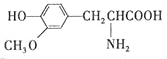 ��
��  ���Ǧ����������һ�Ϊͬϵ��
���Ǧ����������һ�Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
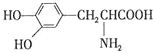
����Ŀ���������ƣ� ![]() ����дΪNaA�����������ϵķ��������о����������ᣨHA�����־�������������A�� �� ��֪25��ʱ��HA��Ka=6.25��10��5 �� H2CO3��Ka1=4.17��10��7 �� Ka2=4.90��10��11 �� ������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壬����˵����ȷ���ǣ��¶�Ϊ25�棬�����������������ɷ֣��� ��
����дΪNaA�����������ϵķ��������о����������ᣨHA�����־�������������A�� �� ��֪25��ʱ��HA��Ka=6.25��10��5 �� H2CO3��Ka1=4.17��10��7 �� Ka2=4.90��10��11 �� ������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壬����˵����ȷ���ǣ��¶�Ϊ25�棬�����������������ɷ֣��� ��
A.�����δ��CO2�����ϣ�̼�����ϵ��־������ϵ�
B.���CO2����ѹ����������c��A��������
C.��pHΪ5.0ʱ��������![]() =0.16
=0.16
D.̼�������и������ӵ�Ũ�ȹ�ϵΪ��c��H+��=c��HCO3����+c��CO32����+c��OH������c��HA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������F��һ����Ҫ���л��ϳ��м��壬���ĺϳ�·�����£�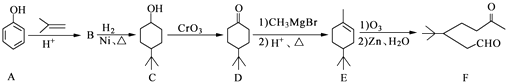
��1��������F�к��������ŵ��������� ��
��B����C�Ļ�ѧ��Ӧ������ ��
��2��д��������C�����ᷴӦ�������Ļ�ѧ����ʽ�� ��
��3��д��������B�Ľṹ��ʽ�� ��
��4��ij��������D��ͬ���칹�壬�ҷ�����ֻ�����ֲ�ͬ��ѧ�������⣮д���û�
����Ľṹ��ʽ������дһ�֣���
��5�����������֪ʶ����������Ϣ��д���Ա��ӣ� ![]() ����CH2=CH2Ϊԭ���Ʊ�
����CH2=CH2Ϊԭ���Ʊ�
�л��� ![]() �ĺϳ�·������ͼ�����Լ����ã���
�ĺϳ�·������ͼ�����Լ����ã���
�ϳ�·������ͼʾ�����£� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���о���������Cu/ZnO���������£�CO2��H2�ɷ�������ƽ�з�Ӧ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£�
CO2��g��+3H2��g��CH3OH��g��+H2O��g����H1=��53.7kJmol��1 ��
CO2��g��+H2��g��CO��g��+H2O��g����H2 ��
ijʵ���ҿ���CO2��H2��ʼͶ�ϱ�Ϊ1��2.2������ͬѹǿ�£�������ͬ��Ӧʱ��������ʵ�����ݣ�
T��K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[��ע]Cat.1��Cu/ZnO���װ���Cat.2��Cu/ZnO����Ƭ���״�ѡ���ԣ�ת����CO2�����ɼ״��İٷֱ�
��֪����CO��H2�ı�ȼ���ȷֱ�Ϊ��283.0kJmol��1�ͩ�285.8kJmol��1 ��
��H2O��1���TH2O��g����H3=44.0kJmol��1
��ش𣨲������¶ȶԡ�H��Ӱ�죩��
��1����ӦI��ƽ�ⳣ������ʽK=����Ӧ��ġ�H2=kJmol��1 ��
��2�����������CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ�� ��
A.ʹ�ô���Cat.1
B.ʹ�ô���Cat.2
C.���ͷ�Ӧ�¶�
D.Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
E.���� CO2��H2�ij�ʼͶ�ϱ�
��3������ʵ�����ݱ���������ͬ�¶��²�ͬ�Ĵ�����CO2ת����CH3OH��ѡ������������Ӱ�죬��ԭ���� ��
��4������ͼ�зֱ���ӦI����������Cat.1����Cat.2��������¡���Ӧ���̩�������ʾ��ͼ��
��5���о�֤ʵ��CO2Ҳ��������ˮ��Һ��ͨ��������ɼ״��������ɼ״��ķ�Ӧ�����������õ缫��Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����(����)
A. ɳ�ӡ�ʯӢ��ˮ������Ҫ�ɷֶ���SiO2
B. �Ʋ�����ˮ���ԭ�϶��õ�ʯ��ʯ
C. ���ڳ����²������������������ᷴӦ
D. һ��������SiO2����������ᷴӦ�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A.������ƿ������Һʱ����������ˮϴ�ӣ����ô�װҺ��ϴ
B.�������ɺ���Fe3��������ˮ��ȡ�ϴ�����ˮ
C.��ɫ��Ӧ����ϡ����ϴ�Ӳ�˿���ڻ�������������ɫ���ٽ����������ʵIJ���
D.����þ�Ż����ɳ�Ӹ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com