
| A. | 1.7g OH- 所含电子数为0.9NA | |
| B. | 标准状况下,11.2 L HCl 所含质子数为18NA | |
| C. | 7.8gNa2O2固体中含有的离子数为4NA | |
| D. | 0.5 mol D2O 中所含质子数为5NA |
分析 A、氢氧根离子物质的量=$\frac{m}{M}$计算物质的量,氢氧根离子含有10个电子;
B、HCl物质的量=$\frac{V}{{V}_{m}}$计算物质的量,HCl含有18个电子;
C、求出Na2O2的物质的量,然后根据1molNa2O2含2molNa+和1molO22-来分析;
D、重水中含有10个质子,0.5mol重水,含有5mol质子.
解答 解:A、1.7g OH- 所含电子数=$\frac{1.7g}{17g/mol}$×10×NA=NA,故A错误;
B、标准状况下,11.2 L HCl 所含质子数=$\frac{11.2L}{22.4L/mol}$×18×NA=9NA ,故B错误;
C、7.8gNa2O2的物质的量为0.1mol,而1molNa2O2含2molNa+和1molO22-,故0.1molNa2O2含0.1molO22-,故C错误;
D、重水中含有10个质子,0.5mol重水含有5mol质子,所含质子数为5NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用主要是微粒数的计算应用,微粒结构,氧化还原反应,气体摩尔体积的条件分析,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
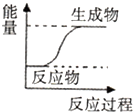
| A. | C+C02 $\frac{\underline{\;高温\;}}{\;}$2CO | B. | Zn+H2S04=ZnS04+H2↑ | ||
| C. | CH4+202$\stackrel{点燃}{→}$C02+2H20 | D. | K0H+HN03=KN03+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
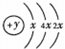 ,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素.
,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯酚) | A.饱和Na2CO3溶液 B.NaOH溶液 C.CaO | a.过滤 b.蒸馏 c.分液 | ① | ||
| ②乙醇(水) | ② | ||||
| ③乙酸乙酯(乙酸) | ③ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
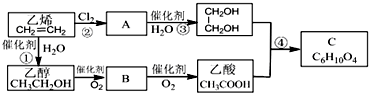
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
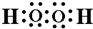 含有的化学键类型有BC(填序号).
含有的化学键类型有BC(填序号). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:D>C>B,第一电离能:C>D>B,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出H2.G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍.
已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:D>C>B,第一电离能:C>D>B,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出H2.G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍.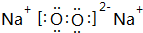 .它与F2D3按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为2Na2O2+2Al2O3=4NaAlO2+O2↑.
.它与F2D3按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为2Na2O2+2Al2O3=4NaAlO2+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液可用于检验淀粉是否发生水解 | |
| B. | 植物油的主要成分是高级脂肪酸 | |
| C. | 蔗糖及其水解产物均可发生银镜反应 | |
| D. | 鸡蛋清溶液中加入饱和硫酸钠溶液,生成的沉淀物不能再溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
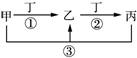 甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系见图,下列说法正确的是( )
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系见图,下列说法正确的是( )| A. | 若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3 | |
| B. | 若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O | |
| C. | 若甲、乙、丙的溶液显碱性,则丙可能可以作为医疗上治疗胃酸过多症的药剂 | |
| D. | 若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com