
【题目】按要求回答问题
(1)NaHSO4与NaHCO3溶液反应离子方程式 .
(2)KClO3+6HCl═KCl+3Cl2↑+3H2O ①氧化剂与还原剂的物质的量的比为 .
②氧化产物与还原产物的物质的量的比 .
(3)已知下面三个反应:2Fe2++Cl2=2Fe3++2Cl﹣;2Fe2++Br2═2Fe3++2Br﹣; 2Br﹣+Cl2═Br2+2Cl﹣①根据以上三个反应,判断还原剂的还原性由强到弱的顺
②写出氯气和溴化亚铁以物质的量之比为3:4的离子反应方程式 .
【答案】
(1)H++HCO3﹣═CO2↑+H2O
(2)1:5;5:1
(3)Fe2+>Br﹣>Cl﹣;4Fe2++2Br﹣+3Cl2═4Fe3++Br2+6Cl﹣
【解析】解:(1)NaHSO4溶液与NaHCO3溶液反应生成硫酸钠、水和二氧化碳,离子方程式:H++HCO3﹣═CO2↑+H2O,所以答案是:H++HCO3﹣═CO2↑+H2O;(2)KClO3+6HCl ![]() KCl+3Cl2↑+3H2O中,Cl元素的化合价由﹣1价升高为0,失去电子被氧化,5molHCl作还原剂,对应氧化产物;Cl元素的化合价由+5价降低为0,得到电子被还原,对应还原产物,所以氧化剂与还原剂的物质的量的比为1:5,氯气既是氧化产物又是还原产物,由Cl原子守恒可知,氧化产物与还原产物的质量比为5:1,所以答案是:①1:5;②5:1;(3)①根据还原剂的还原性强于还原产物的还原性,由:2Fe2++Cl2=2Fe3++2Cl﹣ , 还原性:Fe2+>Cl﹣;由2Fe2++Br2═2Fe3++2Br﹣ , 还原性:Fe2+>Br﹣;由 2Br﹣+Cl2═Br2+2Cl﹣还原性:Br﹣>Cl﹣;所以答案是:Fe2+>Br﹣>Cl﹣;②氯气和溴化亚铁以物质的量之比为3:4,设氯气的物质的量为3mol,则溴化亚铁的物质的量为4mol,而4mol的亚铁离子失去4mol的电子,而氯气需得到6mol的电子,所以参加反应的亚铁为2mol,离子反应方程式为:4Fe2++2Br﹣+3Cl2═4Fe3++Br2+6Cl﹣ , 所以答案是:4Fe2++2Br﹣+3Cl2═4Fe3++Br2+6Cl﹣ .
KCl+3Cl2↑+3H2O中,Cl元素的化合价由﹣1价升高为0,失去电子被氧化,5molHCl作还原剂,对应氧化产物;Cl元素的化合价由+5价降低为0,得到电子被还原,对应还原产物,所以氧化剂与还原剂的物质的量的比为1:5,氯气既是氧化产物又是还原产物,由Cl原子守恒可知,氧化产物与还原产物的质量比为5:1,所以答案是:①1:5;②5:1;(3)①根据还原剂的还原性强于还原产物的还原性,由:2Fe2++Cl2=2Fe3++2Cl﹣ , 还原性:Fe2+>Cl﹣;由2Fe2++Br2═2Fe3++2Br﹣ , 还原性:Fe2+>Br﹣;由 2Br﹣+Cl2═Br2+2Cl﹣还原性:Br﹣>Cl﹣;所以答案是:Fe2+>Br﹣>Cl﹣;②氯气和溴化亚铁以物质的量之比为3:4,设氯气的物质的量为3mol,则溴化亚铁的物质的量为4mol,而4mol的亚铁离子失去4mol的电子,而氯气需得到6mol的电子,所以参加反应的亚铁为2mol,离子反应方程式为:4Fe2++2Br﹣+3Cl2═4Fe3++Br2+6Cl﹣ , 所以答案是:4Fe2++2Br﹣+3Cl2═4Fe3++Br2+6Cl﹣ .


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】“雾霾”成为人们越来越关心的环境问题。雾霾中含有二氧化硫、氮氧化物和可吸入颗粒物等污染性物质。请回答下列问题:
(1)汽车尾气是雾霾形成的原因之一。尾气治理可用汽油中挥发出来的烃类物质(CxHy)催化还原尾气中的NO气体,该过程的化学方程式为___________________。
(2)冬季燃煤供暖产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:①N2(g)+O2(g)![]() 2NO(g) ΔH1=+180.5 kJ·mol-1
2NO(g) ΔH1=+180.5 kJ·mol-1
②2CO(g)![]() 2C(s)+O2(g) ΔH2=+221 kJ·mol-1
2C(s)+O2(g) ΔH2=+221 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3=-393.5 kJ·mol-1
CO2(g) ΔH3=-393.5 kJ·mol-1
则ΔH=_____________。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图一所示,电极材料为石墨。
①a表示_____离子交换膜(填“阴”或“阳”)。A~E分别代表生产中的原料或产品,其中C为硫酸,则A表示_________,E表示___________。
②阳极的电极反应式为___________________________。
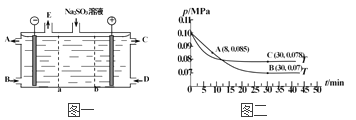
(4)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
2SO3(g)。若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2[其中n(SO2) ∶n(O2)=2∶1],测得容器内总压强与反应时间如图二所示。
①图中A点时,SO2的转化率为____________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)______vA(逆)(填“>”、“<”或“=”)。
③图中B点的压强平衡常数Kp=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,能说明乙酸的酸性比碳酸强的是
A. 乙酸具有挥发性 B. 乙酸有刺激性气味
C. 乙酸是有机酸而碳酸是无机酸 D. 乙酸能与碳酸氢钠反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是
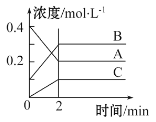
A.发生的反应可表示为:2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B.前2 min A的分解速率为0.1 mol·L1·min1
C.开始时,正逆反应同时开始
D.2 min时,A、B、C的浓度之比为2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示).滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.请回答下列问题: 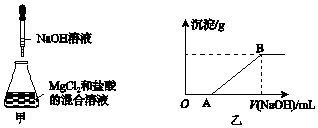
(1)溶解MgCl2固体需要的玻璃仪器有(填字母). a.天平b.烧杯c.漏斗d.玻璃棒
(2)AB段反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用反应:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O来制取NO,当有6.4gCu参加反应时,计算:
(1)用双线桥法标出电子转移的方向和数目;
(2)能生成多少升NO(标准状况下);
(3)使生成的Cu(NO3)2中Cu2+全部转化成沉淀,则至少需要质量分数为40%密度为1.42g/ml的NaOH溶液体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓硫酸试剂瓶的标签,试根据标签上的有关数据回答下列问题: 
(1)该浓硫酸中H2SO4的物质的量浓度为 .
(2)某学生欲用上述浓硫酸和蒸馏水配制250mL物质的量浓度为0.4molL﹣1的稀硫酸,该学生需要量取mL上述浓硫酸进行配制.
(3)为配制(2)中的稀硫酸,下列可供选用的仪器中,一定用到的是(填编号),配制过程中还缺少的仪器是(填写仪器名称) ①玻璃棒; ②胶头滴管; ③量筒; ④药匙;⑤圆底烧瓶; ⑥天平; ⑦烧杯; ⑧普通漏斗
(4)在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是(填序号). ①定容时俯视观察
②定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
③浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
④容量瓶使用时未干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 在金属的冶炼方法中,铝热法,本质上属于热还原法
B. 化学上所说的钢铁,其实钢是钢,铁是铁,钢是混合物,而铁是纯净物
C. 对于反应:FeCuS2 + S![]() FeS2 + CuS,其中FeS2既是氧化产物又是还原产物
FeS2 + CuS,其中FeS2既是氧化产物又是还原产物
D. 已知BrCl的化学性质跟Cl2相似,则BrCl跟水反应(生成HCl和HBrO)也是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含的原子数一定相等的是( )
①同质量、不同密度的Cl2和CO ②同温度、同体积的H2和 N2
③同体积、同密度的 C2H4和C3H6两种气体 ④同压强、同体积的N2O 和 CO2两种气体.
A.①③
B.③
C.③④
D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com