
����Ŀ����������װ��(�������ظ�ʹ��)�Ʊ�PH3��֤��PH3����ǿ��ԭ�Ժ��Ȳ��ȶ��ԡ���֪: ����״̬ʱPH3��һ����ɫ������ˮ���о綾������,����ǿ��ԭ��,�ڿ���������ȼ; �ڰ���(P4)������Ϊ��ɫ���ɫ��״����,������ˮ,�ڿ���������ȼ;��������һ���ӷ���Һ��,�е�34.6��,���ܽ���ס�
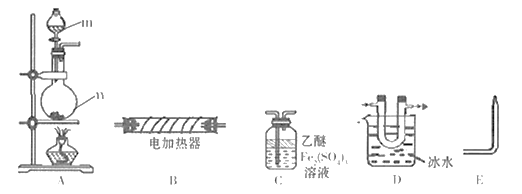
(1)����m������Ϊ_________��װ��C����Ϊ____________��
(2)ʵ�����ð�����NaOHŨ��Һ��Ӧ����NaHPO2��ͬʱ�Ƶ�PH3,��Ӧ�Ļ�ѧ����ʽΪ___________��
(3)��װ��A��ȡPH3��ʵ��ǰ,������n�м������������ѺͰ��ײ��ȣ�Ȼ��ŵ���ŨNaOH��Һ��ʵ��ǰ���ȵ�Ŀ����___________��
(4)��A��C��E��������,����(3)�в�������ŨNaOH��Һ��,ͬʱ��ȼE�����������壬��װ��C����Һ��ɫ��dz,ͬʱ�õ���ɫ��״����,˵��PH3����____��,װ��C�з����Ļ�ѧ��Ӧ����ʽΪ_________����ȼE�������Ŀ��Ϊ______________��
(5)������װ�������֤��PH3�����ѷֽ�,����֤PH3���ȷֽ���������,����������˳��Ϊ
A![]()
![]() D
D![]()
![]() ______
______![]() E( �ڡ�
E( �ڡ�![]() ��֮��Ŀհ״���дװ�ñ��)��
��֮��Ŀհ״���дװ�ñ��)��
��֤��PH3�ֽ����������������_________________��
���𰸡� ��Һ©�� ϴ��ƿ P4+3NaOH +3H2O![]() 3NaH2PO2+ PH3�� �ų�װ���еĿ���,��ֹP4��PH3��ȼ ��ԭ 6Fe2(SO4)3+4PH3 =P4��+12FeSO4+6H2SO4 PH3�ж�,��ֹ��Ⱦ���� B
3NaH2PO2+ PH3�� �ų�װ���еĿ���,��ֹP4��PH3��ȼ ��ԭ 6Fe2(SO4)3+4PH3 =P4��+12FeSO4+6H2SO4 PH3�ж�,��ֹ��Ⱦ���� B![]() D
D![]() C
C![]() C �ڶ�ƿC����Һ����ɫ,��ȼE������.�������ɫ
C �ڶ�ƿC����Һ����ɫ,��ȼE������.�������ɫ
�����������������(1)����װ��ͼ�ش�����m��������װ��C��������(2)���ݵ�ʧ�����غ���ƽ����ʽ��(3). ���ȿ���ʹ���ѻӷ����ų�װ���еĿ�����(4)��װ��C����Һ��ɫ��dz,ͬʱ�õ���ɫ��״������˵���а���������װ��C��Fe2(SO4)3��PH3 ��Ӧ����P4��FeSO4��H2SO4��PH3�ж�,ȼ�տ��Է�ֹ��Ⱦ����(5) PH3���ȷֽ�����������,��PH3����ͨ������ȹ�B��ͨ��װ��D�ռ�������ͨ��C��ȥʣ���PH3���ٴ�ͨ��C֤��PH3������������ͨ��װ��E����ȼ����֤���������ɡ����ڶ�ƿC����Һ����ɫ��˵��PH3�����ѳ�������ȼE���������������ɫ˵����������
������(1)����װ��ͼ������m�������Ƿ�Һ©����װ��C������ϴ��ƿ��(2)������NaOHŨ��Һ��Ӧ����NaHPO2��PH3����Ӧ�Ļ�ѧ����ʽΪP4+3NaOH +3H2O![]() 3NaH2PO2+ PH3����(3).���ȿ���ʹ���ѻӷ����ų�װ���еĿ�������ֹP4��PH3��ȼ��(4)��װ��C����Һ��ɫ��dz,ͬʱ�õ���ɫ��״������˵���а���������˵��PH3���л�ԭ����װ��C��Fe2(SO4)3��PH3 ��Ӧ����P4��FeSO4��H2SO4����Ӧ����ʽ��6Fe2(SO4)3+4PH3 =P4��+12FeSO4+6H2SO4��PH3�ж�,ȼ�տ��Է�ֹ��Ⱦ������(5) PH3���ȷֽ�����������,��PH3����ͨ������ȹ�B��ͨ��װ��D�ռ�������ͨ��C��ȥʣ���PH3���ٴ�ͨ��C֤��PH3������������ͨ��װ��E����ȼ����֤���������ɣ���������������˳����A
3NaH2PO2+ PH3����(3).���ȿ���ʹ���ѻӷ����ų�װ���еĿ�������ֹP4��PH3��ȼ��(4)��װ��C����Һ��ɫ��dz,ͬʱ�õ���ɫ��״������˵���а���������˵��PH3���л�ԭ����װ��C��Fe2(SO4)3��PH3 ��Ӧ����P4��FeSO4��H2SO4����Ӧ����ʽ��6Fe2(SO4)3+4PH3 =P4��+12FeSO4+6H2SO4��PH3�ж�,ȼ�տ��Է�ֹ��Ⱦ������(5) PH3���ȷֽ�����������,��PH3����ͨ������ȹ�B��ͨ��װ��D�ռ�������ͨ��C��ȥʣ���PH3���ٴ�ͨ��C֤��PH3������������ͨ��װ��E����ȼ����֤���������ɣ���������������˳����A![]() B
B![]() D
D![]() C
C![]() C
C ![]() E�����ڶ�ƿC����Һ����ɫ��˵��PH3�����ѳ�������ȼE���������������ɫ˵��������������
E�����ڶ�ƿC����Һ����ɫ��˵��PH3�����ѳ�������ȼE���������������ɫ˵��������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
(��)ij̽��С����HNO3�����ʯ��Ӧ������������С�ķ������о�Ӱ�췴Ӧ���ʵ����ء�����HNO3Ũ��Ϊ1.00mol/L��2.00mol/L������ʯ��ϸ�����ʹֿ������ֹ��ʵ���¶�Ϊ25�桢35�棬ÿ��ʵ��HNO3������Ϊ25.00mL������ʯ����Ϊ10.00g��
���������ʵ����Ʊ�������ʵ��Ŀ��һ������գ�
ʵ�� ��� | �¶� ���棩 | ����ʯ ��� | HNO3Ũ�ȣ�mol/L�� | ʵ��Ŀ�� |
�� | 25 | �ֿ��� | 2.00 | (I)ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죻 (II)ʵ��ٺ͢�̽���¶ȶԷ�Ӧ���ʵ�Ӱ�죻 (III)ʵ��ٺ͢�̽��______________�Է�Ӧ���ʵ�Ӱ�� |
�� | 25 | �ֿ��� | _______ | |
�� | _____ | �ֿ��� | 2.00 | |
�� | 25 | ϸ���� | 2.00 |
(��)��2.5 mol A��2.5 mol B��Ϸ���2 L�ܱ������������Ӧ��3A(g)��B(g)![]() xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
xC(g)��2D(g)����5 s��Ӧ��ƽ�⡣�ڴ�5 s��C��ƽ����Ӧ����Ϊ0.2 mol/(L��s)��ͬʱ����1 mol D������
��1����ƽ��ʱB��ת����Ϊ_____________________��
��2��x��ֵΪ___________________��
��3�����¶Ȳ��䣬��ƽ��ʱ�����������ѹǿ�Ƿ�Ӧǰ��____________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӧ��������Ⱦ�����ƿ���������Ҫ�Ӷ�����֣��翪�����������Դ���״���һ�ֿ������������Դ�����й����Ŀ�����Ӧ��ǰ����
��.��֪����CH3OH��g��+H2O��l��=CO2��g��+3H2��g�� ��H=+93.0kJ��mol��1
��CH3OH(g)��1/2O2(g)=CO2(g)��2H2(g) ��H����192.9 kJ��mol��1
��CH3OH(g)=CH3OH(l) ��H����38.19 kJ��mol��1
���ʾCH3OH��ȼ���ȵ��Ȼ�ѧ����ʽΪ______________________________________________��
��.��һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2��g��![]() CH3OH��g������2L�����ܱ������г���1mol CO��2molH2���ڴ��������³�ַ�Ӧ����ͼ��ʾƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ƽ�����ߡ��ش��������⣺
CH3OH��g������2L�����ܱ������г���1mol CO��2molH2���ڴ��������³�ַ�Ӧ����ͼ��ʾƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ƽ�����ߡ��ش��������⣺
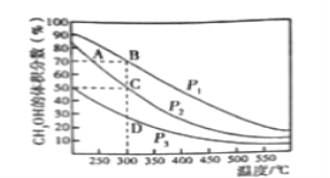
��1���÷�Ӧ�ķ�Ӧ����H_______0������>������<������ѹǿ����Դ�С��p1_______p2������>������<������
��2��ѹǿΪp2���¶�Ϊ300��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=________________��
��3�����и����У�����˵���÷�Ӧ�Ѿ��ﵽƽ�����________________________________��
A������������ѹǿ���ٱ仯 B��v��CO����c��H2����v��CO3OH��=1:2:1
C�������ڵ��ܶȲ��ڱ仯 D�������ڻ�������ƽ����Է����������ٱ仯
E.�����ڸ���ֵ������������ٱ仯
��4��ij�¶����ڱ�֤H2Ũ�Ȳ��������£����������������ƽ��_________������ĸ����
A��������Ӧ�����ƶ� B�����淴Ӧ�����ƶ� C�����ƶ�
�������жϵ�������__________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A. ��NaCl��Һ��1��1ͨ��NH3��CO2�Ʊ�NaHCO3
B. 500�����ұ�ͨ��״���¸������ںϳɰ�
C. ʵ�����г����ű���ʳ��ˮ�ķ����ռ�����
D. ��ҵ����������Ĺ�����ʹ�ù����Ŀ�������߶��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[ѡ��5-�л���ѧ����]�л���F��һ����Ҫ�ľ�ϸ�����ϳ��м��壬��ϳ���·��ͼ:
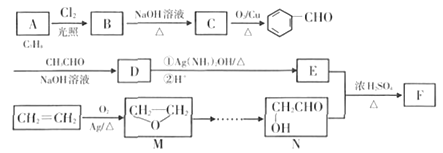
��֪: ![]() ���ش���������:
���ش���������:
(1)�л���A��C�����Ʒֱ�Ϊ______��_____��D![]() E�ķ�Ӧ����Ϊ__________��
E�ķ�Ӧ����Ϊ__________��
(2)�л���F�Ľṹ��ʽΪ________��д��B ![]() C��Ӧ����ʽ__________��
C��Ӧ����ʽ__________��
(3)�л���D�к��������ŵ�����Ϊ_______,��Ҫ֤��D�к��С�![]() ��������,ʵ�鷽��Ϊ_______��
��������,ʵ�鷽��Ϊ_______��
(4)E��ͬ���칹���ж���,�������ڷ����廯�������ʹ������Ȼ�̼��Һ��ɫ,����������������Һ�з���ˮ�ⷴӦ��ͬ���칹����__________�֡�
(5)��������(![]() )��һ����Ҫ��ʯ����Ʒ����ѧ���ʻ���,����ˮ��±���⡢�Ҵ��Ⱥܶ�����a�������ӳɷ�Ӧ��д����M
)��һ����Ҫ��ʯ����Ʒ����ѧ���ʻ���,����ˮ��±���⡢�Ҵ��Ⱥܶ�����a�������ӳɷ�Ӧ��д����M![]() N�ĺϳ�·��:____________��
N�ĺϳ�·��:____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�������ʣ��Ҿ�����ͬһ��Ԫ�أ�����֮��������ת��������A�ǵ��ʡ�
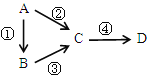
��1����C�ǵ���ɫ���峣���ں�������еĹ�������D��һ��ǿ���C��������ʱ��CO2��Ӧ�Ļ�ѧ����ʽΪ_______________________�����л�ԭ����________������������___________��7.8g C�μӷ�Ӧʱת�Ƶĵ�������___________��
��2����B��D��������ǿ����Һ����������ǿ����Һ����Ӧ�ڢ۾���Ҫǿ������Һ����Ӧ�ܿ���ͨ���μ�����ϡ����ʵ�֡��ݴ�д��AԪ�ص�ԭ�ӽṹʾ��ͼ��______����д��A���ں�������Ļ�ѧ����ʽ___________________________����д���ڵ����ӷ���ʽ_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2X ��H2Y��Ϊ��Ԫ����������������NaOH ��Һ�ֱ�ӵ�H2X ��H2Y����Һ�����ڲ�ͬpH �����²�ͬ��̬�����������ᡢ��ʽ������������������ɷ�����ͼ��ʾ��
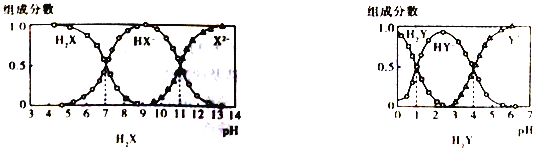
����˵����ȷ����
A. ��pH=7����Һ��HX-��X2-��HY-��Y2-�ܴ�������
B. ��Na2X��Һ�м�������H2Y ��Һ��������Ӧ��X2-+H2Y==HX-+HY-
C. 1L.0.1mol��L-1NaHY��Һ��n(HY-)+2n(Y2-)+n(H2Y) =0.1mol
D. HX-��ˮ��ƽ�ⳣ��ΪKb=10-7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2(g)��3H2(g) ![]() 2NH3(g)����H<0�����и����ʾ��ͼ�Ľ�����ͼ���������
2NH3(g)����H<0�����и����ʾ��ͼ�Ľ�����ͼ���������

A. ��ѹǿ�Է�Ӧ��Ӱ��(p2>p1) B. ���¶ȶԷ�Ӧ��Ӱ��
C. ��ƽ����ϵ����N2�Է�Ӧ��Ӱ�� D. �ܴ����Է�Ӧ��Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��������������ʵ������ת�����ǣ� ��
A.Cl2��Cl��
B.H+��H2
C.MnO2��Mn2+
D.Zn��Zn2+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com