
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示:
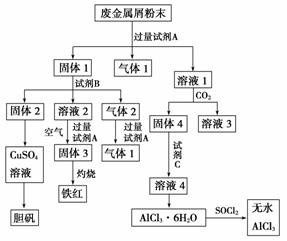
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(2)溶液2中含有的金属阳离子是__________;气体2的成分是__________。
(3)溶液2转化为固体3的反应的离子方程式是________________________________
________________________________________________________________________。
(4)利用固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是_______________________________________________ _____________________。
_____________________。
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是_________________________________________________________
________________________________________________________________________。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是________________________________________________________________________
________________________________________________________________________。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是______________________________________________________________。
答案 (1)2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
(2)Fe2+ CO2和H2
(3)4Fe2++8OH-+O2+2H2O===4Fe(OH)3↓
(4)①Cu+2H2SO4(浓)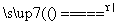 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
②2Cu+4H++O2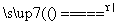 2Cu2++2H2O
2Cu2++2H2O
(5)若在溶液1中直接加入盐酸,会使溶液4中混有试剂A中的阳离子(如Na+等),而不是纯净的AlCl3溶液
(6)AlCl3·6H2O+6SOCl2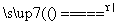 AlCl3+12HCl↑+6SO2↑
AlCl3+12HCl↑+6SO2↑
解析 由溶液1和CO2反应可知试剂A为NaOH溶液;溶液1为Na[Al(OH)4],固体4为Al(OH)3,溶液4为AlCl3溶液;固体1为Cu、Fe、Cu2(OH)2CO3、铁锈,由固体2最终到胆矾可知固体2为Cu,试剂B为非氧化性酸,溶液2为Fe2+、气体2为CO2[Cu2(OH)2CO3与酸反应生成]和H2,溶液2到固体3有空气存在所以应该生成Fe(OH)3。


科目:高中化学 来源: 题型:
下列反应中不需加热的吸热反应是( )
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
X、Y、Z、W四种元素的符号:
X 、Y 、Z 、W 。
查看答案和解析>>
科目:高中化学 来源: 题型:
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70% Cu、25% Al、4% Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
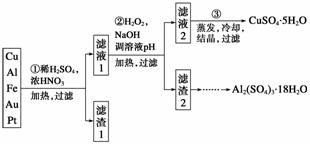
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________________
________________________________________________________________________;
得到滤渣1的主要成分为____________。
(2)第②步加H2O2的作用是______________,使用H2O2的优点是______________;调溶液pH的目的是使______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________________________。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
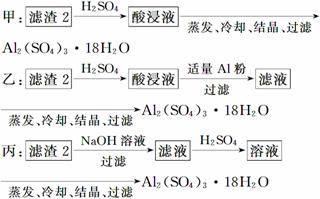
上述三种方案中,________方案不可行,原因是_______________________________
________________________________________________________________________;
从原子利用率角度考虑,__________方案更合理。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物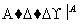 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物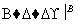 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是 ( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是( )
A.25 ℃时,CuS的溶解度大于ZnS的溶解度
B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C.物质的量浓度相同的FeCl2、ZnCl2混合液中加入少量Na2S,只有FeS沉淀生成
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.0.1 mol/L (NH4)2SO4溶液中的c(NH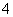 )<c(SO
)<c(SO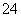 )
)
B.相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是21
C.向0.1 mol/L NaNO3溶液中滴加盐酸使溶液pH=5,此时混合液中的c(Na+)=c(NO )
)
D.常温下,向醋酸钠溶液中加入适量醋酸,使混合液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
碳的燃烧热为393.5 kJ/mol,下列热化学方程式正确的是
A.C(s)+O2(g)=CO2(g) △H = + 393.5 kJ/mol
B.C(s)+1/2O2(g)=CO(g) △H = - 393.5 kJ/mol
C.C + O2 = CO2 △H = - 393.5 kJ/mol
D.C(s)+O2(g)=CO2(g) △H = - 393.5 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com