
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
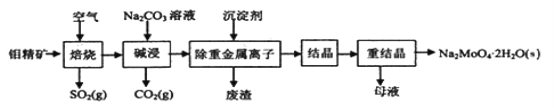
回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为_____________,氧化产物是________(写化学式)。每转化生成1molMoO3时,需要转移的电子数是 _________。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
【答案】粉碎固体颗粒(其他合理答案也给分) 2MoS2 +7O2![]() 2MoO3 +4SO2MoO3、SO214MoO3+Na2CO3=Na2MoO4 +CO2↑PbS MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O
2MoO3 +4SO2MoO3、SO214MoO3+Na2CO3=Na2MoO4 +CO2↑PbS MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O
【解析】
(1)提高固体燃烧效率的方法为增大固体的接触面积,即粉碎固体颗粒;(2) “焙烧”时MoS2转化为MoO3,钼元素的化合价升高,说明被氧气氧化,从流程分析,产物还有二氧化硫,所以方程式为:2MoS2 +7O2![]() 2MoO3 +4SO2 ,其中MoO3 和SO2为氧化产物;每转化生成1molMoO3时,消耗3.5mol氧气,则需要转移的电子数为14mol; (3)加入碳酸钠溶液进行碱浸,二者反应后生成二氧化碳,故方程式为:MoO3+Na2CO3=Na2MoO4 +CO2↑; (4)有钼精矿的杂质为硫化铅分析,除重金属离子就是除去溶液中的铅,加入的沉淀剂为Na2S,所以废渣为硫化铅;(5)次氯酸根离子做氧化剂,将MoS2氧化成MoO42-和SO42-,发生反应的离子方程式为: MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O。
2MoO3 +4SO2 ,其中MoO3 和SO2为氧化产物;每转化生成1molMoO3时,消耗3.5mol氧气,则需要转移的电子数为14mol; (3)加入碳酸钠溶液进行碱浸,二者反应后生成二氧化碳,故方程式为:MoO3+Na2CO3=Na2MoO4 +CO2↑; (4)有钼精矿的杂质为硫化铅分析,除重金属离子就是除去溶液中的铅,加入的沉淀剂为Na2S,所以废渣为硫化铅;(5)次氯酸根离子做氧化剂,将MoS2氧化成MoO42-和SO42-,发生反应的离子方程式为: MoS2+9ClO+6OH=MoO42-+9Cl+2SO42-+3H2O。


科目:高中化学 来源: 题型:
【题目】设在容积可变的密闭容器中充入10 mol N2(g)和10 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。计算[(1)、(2)的计算都需按格式写计算过程,否则答案对也不给分]
(1)该条件下反应N2(g)+3H2(g)![]() 2NH3(g) 的平衡常数________。(设该条件下,每1mol气体所占的体积为VL)
2NH3(g) 的平衡常数________。(设该条件下,每1mol气体所占的体积为VL)
(2)上述反应的平衡时,再充入10 mol的N2,根据计算,平衡应向什么方向移动________
(3)某温度下将所得的氨气配成0.1 molL-1的溶液,所得溶液的pOH_____;将该溶液冲稀100倍;计算此时氨水的电离度为________(已知该温度下Kb(NH3·H2O) =1.0×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化:

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是______。
(2)根据上图反应关系,写出下列B、F所含物质成分的化学式:B______;F_____。
(3)写出过程反应①的离子方程式_________________,固体B所含对应的金属其单质与磁性氧化铁在高温下反应的化学方程式__________________________。
(4)写出③中盐酸过量时的离子反应方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于________区。某一次性电池负极材料是Zn,正极材料是Mn的一种常见氧化物,放电后生成MnOOH,电解质是KOH。该电池的正极反应式为__________________________。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为________,该能层具有的原子轨道数为________。BH4-的立体构型是________。
(3)单质Cu的晶体类型为______,晶体中组成微粒通过________作用形成面心立方密堆积,其中Cu原子的配位数为______。在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是________,乙醛分子中∠HCO的键角________乙醇分子中∠HCO的键角(填“大于”、“等于”或“小于”)。
(4)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为________,δ、γ、α三种晶胞的边长之比为________。
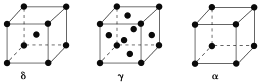
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸)。
(1)实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体。
①该反应的化学方程式为____________________________。
②多余的H2S气体可用_____________溶液来吸收,不能用燃烧的方法处理H2S气体的理由是___________。
(2)用30% FeCl3溶液作吸收液也能吸收H2S气体,反应方程式为:2FeCl3+H2S = S↓+2FeCl2+2HCl,废吸收液经电解可循环使用。
①该反应中H2S显__________(填字母)。
a、不稳定性 b、弱酸性 c、氧化性 d、还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是___________。
③强酸性的废吸收液电解可生成FeCl3和一种分子量最小的气体,则化学方程式为____________。
(3)已知:H2S在高温下分解生成硫蒸气和H2。现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示。
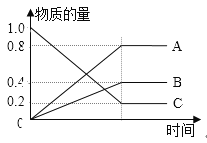
①表示H2的曲线是__________(填“A”、“B”或“C”)。
②生成硫蒸气的分子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是
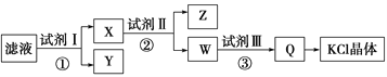
A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既能与盐酸反应又能与氢氧化钠溶液反应的是
①Al ②Al2O3 ③Al(OH)3④Fe
A. ① B. ①② C. ①②③ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com