
| A. | Fe3O4溶于足量稀HNO3中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 将过量的SO2+ClO-+H2O═HClO+HSO3- | |
| D. | 将0.2mol•L-1NH4HCO3溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合:HCO3-+NH4++Ba2++2OH-═NH3•H2O+H2O+BaCO3↓ |
分析 A.稀硝酸能够将亚铁离子氧化成铁离子;
B.氢氧化钡足量,铵根离子也参与反应;
C.次氯酸能够将二氧化硫氧化成硫酸;
D.设溶液体积为1L,碳酸氢铵为0.2mol,氢氧化钡为0.3mol,氢氧化钡过量,铵根离子和碳酸氢根离子都参与反应.
解答 解:A.二者发生氧化还原反应,正确的离子方程式为:3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故A错误;
B.NH4HCO3溶液与足量Ba(OH)2溶液混合,反应生成碳酸钡沉淀、一水合氨和水,正确的离子方程式为:HCO3-+NH4++Ba2++2OH-═NH3•H2O+H2O+BaCO3↓,故B错误;
C.次氯酸能够氧化亚硫酸氢根离子,正确的离子方程式为:ClO-+H2O+SO2═SO42-+2H++Cl-,故C错误;
D.将0.2mol•L-1NH4HCO3溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合,设溶液体积为1L,NH4HCO3的物质的量为0.2mol,Ba(OH)2的物质的量为0.3mol,显然氢氧化钡过量,离子方程式按照碳酸氢铵的化学式组成书写,反应的离子方程式为:HCO3-+NH4++Ba2++2OH-═NH3•H2O+H2O+BaCO3↓,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾易水解生成胶体,可用作净水剂 | |
| B. | 晶体硅熔点高硬度大,可用作芯片 | |
| C. | 氮气化学性质稳定,可用作粮食保护气 | |
| D. | 溴化银见光易分解,可用作胶片感光剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气作水杀菌消毒剂 | B. | 硅胶作袋装食品的干燥剂 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 铝热剂应用于焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若D与盐酸反应,可生成A和B,则X一定是H2O | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径/10-10 nm | 0.73 | 1.30 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.02 |
| 最高或最低化合价 | -2 | +2 | +1 | +5 | +7 | +1 | -3 | +6 |
| A. | ③和⑤处于同一周期 | |
| B. | 气态氢化物的稳定性④大于⑧ | |
| C. | 上述八种元素最高价氧化物对应的水化物中,⑤的酸性最强 | |
| D. | ①与⑥只能形成一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
在一恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol| A. | 该密闭容器的体积为1 L | |
| B. | 从反应开始到平衡,氢气的转化率为0.75 | |
| C. | 从反应开始到平衡,氢气的平均反应速率为0.075 mol/(L•min) | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
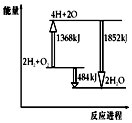
| A. | 拆开2molH2(g)和1molO2(g)中的化学键共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 1molH2(g)和$\frac{1}{2}$molO2(g)反应生成1molH2O(l),放出热量小于242kJ | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com