
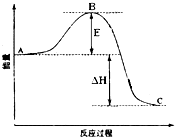
反应过程的能量变化如图所示。已知
氧化为
的
。请回答问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的
反应热有无影响? 。该反应通常用作催化剂,加
会使图中
B点升高还是降低? ,理由是 。
(2)图中
。
(3)的催化循环机理可能为:
氧化
时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 。
(4)如果反应速率为
,则
、
。
(5)已知单质硫的燃烧热为,计算由
生成
的
。
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
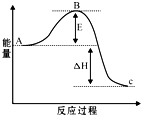 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:查看答案和解析>>
科目:高中化学 来源: 题型:
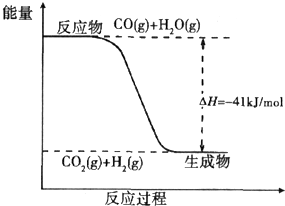 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在400℃、101kPa时,NO2(g)+CO(g)?NO(g)+CO2(g)反应过程的能量变化如图所示.
在400℃、101kPa时,NO2(g)+CO(g)?NO(g)+CO2(g)反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 2CO(g)+O2(g)?2CO2(g)反应过程的能量变化如图所示.已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol.请回答下列问题:
2CO(g)+O2(g)?2CO2(g)反应过程的能量变化如图所示.已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com