
【题目】利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备铝鞣剂[主要成分为Al(OH)2Cl]的一种工艺如图:
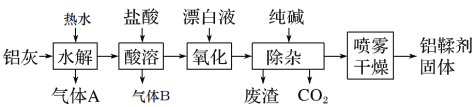
(1)气体A能使湿润的红色石蕊试纸变蓝。铝灰在90℃时水解生成A的化学方程式为:__,“水解”采用90℃而不在室温下进行的原因是___。
(2)“酸溶”时,生成气体B的离子方程式为___。
(3)“氧化”时反应的离子方程式为___。
(4)“除杂”中反应的离子方程式为__。
(5)“喷雾干燥”是将需干燥的物料,分散成很细的像雾一样的微粒,与热空气接触,在瞬间将大部分水分除去,使物料中的固体物质干燥成粉末。采用喷雾干燥而不用蒸发可有效防止产品的水解或分解,写出Al(OH)2Cl在较高温度下分解的化学方程式___。“喷雾干燥”中将需干燥的物料,分散成很细的微粒的目的是___。
【答案】AlN+3H2O![]() Al(OH)3↓+NH3↑ 加快AlN的水解反应速率,降低NH3在水中的溶解度,促使NH3逸出 2Al+6H+=2Al3++3H2↑ 2Fe2++2H++ClO-=2Fe3++Cl-+H2O 3CO32-+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑或表示为:Fe3++3H2O
Al(OH)3↓+NH3↑ 加快AlN的水解反应速率,降低NH3在水中的溶解度,促使NH3逸出 2Al+6H+=2Al3++3H2↑ 2Fe2++2H++ClO-=2Fe3++Cl-+H2O 3CO32-+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑或表示为:Fe3++3H2O![]() Fe(OH)3+3H+;CO32-+2H+=CO2↑+H2O 2Al(OH)2Cl
Fe(OH)3+3H+;CO32-+2H+=CO2↑+H2O 2Al(OH)2Cl![]() Al2O3+2HCl↑+H2O 增大水分蒸发面积,加速干燥过程
Al2O3+2HCl↑+H2O 增大水分蒸发面积,加速干燥过程
【解析】
铝灰的主要成分为Al、Al2O3、AlN、FeO等,加入热水发生水解反应,AlN和水反应生成氢氧化铝和氨气;加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,同时放出氢气;加入漂白剂将亚铁离子氧化为铁离子;加入纯碱,调节溶液pH,使铁离子沉淀,同时放出二氧化碳气体;采用喷雾干燥制备铝鞣剂[主要成分为Al(OH)2Cl]固体,据此分析解答。
(1)气体A能使湿润的红色石蕊试纸变蓝,说明生成的是氨气,铝灰中的AlN和水发生水解反应生成氢氧化铝沉淀和氨气,反应的化学方程式为:AlN+3H2O ![]() Al(OH)3+NH3↑,加热可以促进氮化铝水解生成氨气,降低NH3在水中的溶解度,促使NH3逸出,故答案为:AlN+3H2O
Al(OH)3+NH3↑,加热可以促进氮化铝水解生成氨气,降低NH3在水中的溶解度,促使NH3逸出,故答案为:AlN+3H2O ![]() Al(OH)3+NH3↑;加快AlN水解反应速率,降低NH3在水中的溶解度,促使NH3逸出;
Al(OH)3+NH3↑;加快AlN水解反应速率,降低NH3在水中的溶解度,促使NH3逸出;
(2) “酸溶”时,铝与盐酸反应放出氢气,反应的离子方程式为2Al+6H+=2Al3++3H2↑,故答案为:2Al+6H+=2Al3++3H2↑;
(3)加入漂白液的作用是利用次氯酸根离子在酸溶液中的强氧化性,氧化亚铁离子为铁离子,反应的离子方程式为:2Fe2++2H++ClO-═2Fe3++Cl-+H2O,故答案为:2Fe2++2H++ClO-═2Fe3++Cl-+H2O;
(4)“除杂”中,是用碳酸钠调节溶液pH,使铁离子沉淀,同时放出二氧化碳气体,反应的离子方程式为3CO32-+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑,故答案为:3CO32-+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑;
(5)Al(OH)2Cl在较高温度下分解生成氧化铝,氯化氢和水,反应的化学方程式为2Al(OH)2Cl![]() Al2O3+2HCl↑+H2O;根据题意,“喷雾干燥”中将需干燥的物料,分散成很细的微粒,可以增大水分蒸发面积,加速干燥过程,防止产品的水解或分解,故答案为:2Al(OH)2Cl
Al2O3+2HCl↑+H2O;根据题意,“喷雾干燥”中将需干燥的物料,分散成很细的微粒,可以增大水分蒸发面积,加速干燥过程,防止产品的水解或分解,故答案为:2Al(OH)2Cl![]() Al2O3+2HCl↑+H2O;增大水分蒸发面积,加速干燥过程。
Al2O3+2HCl↑+H2O;增大水分蒸发面积,加速干燥过程。


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为_____。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为____(填化学式)。
(3)元素①、③形成的18电子化合物的电子式为____,元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式)。
(4)元素②、⑤形成化合物的电子式为_____。
(5)元素⑤的最高价氧化物对应的水化物的水溶液与元素⑧的最高价氧化物对应水化物反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。气体X和液体Y不可能是( )
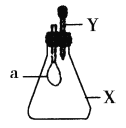
A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在1998年,中国科学家便成功地在较低温度下制造出金刚石:CCl4+4Na![]() C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
C(金刚石)+4NaCl。这项成果被“美国化学与工程新闻”评价为“稻草变黄金”。回答下列问题:
(1)Ni原子价层电子的排布式为_______。元素C、Cl、Na中,第一电离能最大的是______________。
(2)石墨在高温高压下也可转变为金刚石。在石墨和金刚石中,C原子的杂化类型分别为_____________,熔点较高的是_____________,其原因为_______________。
(3)NH3易与Ni形成配合物 [Ni(NH3)6]SO4,该配合物中存在的化学键类型有_____________,其阴离子的空间构型为_____________。
(4)金属间化合物MgCNi3是一种新型超导体,呈钙钛矿构型,X射线衍射实验测得其晶胞参数为a=0.3812nm,其晶胞结构如图所示。晶胞中C位于Ni所形成的正八面体的体心,该正八面体的边长为___________nm。(![]() =1.414)
=1.414)
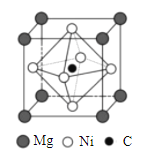
(5)在MgCNi3晶胞结构的另一种表示中,Mg处于体心位置,则C处于________________位置,Ni处于_______________位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
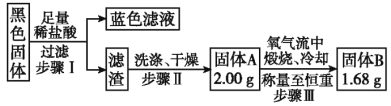
【题目】某研究性学习小组设计如下实验装置进行探究。
⑴装置A中反应的化学方程式为____________。
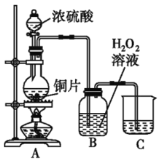
⑵实验结束后,欲验证反应生成的气体具有还原性,小组同学取装置B中溶液少量于一洁净的试管中,应向试管中加入的试剂是___。(填字母)。
a.品红溶液 b.稀盐酸 c.BaCl2溶液 d.稀硝酸
⑶实验结束,小组同学立即熄灭酒精灯,可能导致的后果是______________。
⑷实验结束,发现在铜片表面附着黑色固体。查阅资料得知此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为CuO和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:
①步骤Ⅱ中检验滤渣是否洗涤干净的实验方法是_______________。
②黑色固体的成分是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用所学化学知识解答问题:
(1)微粒![]() 中的质子数是_____,中子数是_____,核外电子数是_____。
中的质子数是_____,中子数是_____,核外电子数是_____。
(2)写出氯离子的原子结构示意图__,写出氯化钠的电子式___,用电子式表示HCl的形成过程___。
(3)NH4NO3是___化合物(填“离子”或“共价”),NaOH所含化学键类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。现取该溶液进行实验,操作和现象如下。有关该溶液的判断正确的是( )
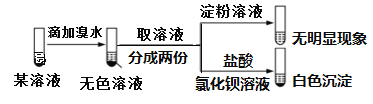
A.肯定不含I﹣B.可能不含SO42-
C.肯定含有SO32-D.肯定含有NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 18g重水(D2O)所含的电子数目为10NA
B. Na2O2与足量的水反应生成1 molO2,转移电子数目为2NA
C. 100 mL1 molL-1 FeCl3溶液中含有 Fe3+数目为 0.1NA
D. 将2molSO2和1molO2充分反应,转移的电子数目为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com