

·ÖĪö £Ø1£©ÅØĻõĖįÓėĶ·“Ӧɜ³ÉĻõĖįĶ”¢¶žŃõ»ÆµŖĘųĢåŗĶĖ®£¬Ąė×Ó·½³ĢŹ½ÖŠÅØĻõĖįŠ“³ÉĄė×ÓŠĪŹ½£»
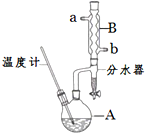
£Ø2£©¹Ų±Õ»īČūb£¬“ņæŖ»īČūa£¬ĶØČėŅ»¶ĪŹ±¼äæÕĘų£¬½«×°ÖĆÖŠµÄÓŠ¶¾ĘųĢåµ¼ČėĒāŃõ»ÆÄĘČÜŅŗÖŠ£¬ČĆĒāŃõ»ÆÄĘČÜŅŗ³ä·ÖĪüŹÕ£»
£Ø3£©Ė®Ō”¼ÓČČĖłŠčŅĒĘ÷ÓŠÉÕ±”¢ĪĀ¶Č¼Ę£¬Ļ“µÓæɳżČ„¼īŹ½Ģ¼ĖįĶ±ķĆęµÄĪüø½µÄĻõĖįÄĘ£»
£Ø4£©ĄūÓĆĢ¼ĖįøłÓėĖį·“Ӧɜ³ÉĘųĢ壬½«Éś³ÉµÄĘųĢåĶعż³ĪĒåµÄŹÆ»ŅĖ®½ųŠŠ¼ģŃ飻
£Ø5£©¼īŹ½Ģ¼ĖįĶĶźČ«·Ö½āµĆµ½CuO£¬Įīѳʷ֊¼īŹ½Ģ¼ĖįĶµÄÖŹĮæ·ÖŹżĪŖx£¬Ōņ¼īŹ½Ģ¼ĖįĶµÄÖŹĮæĪŖ2.42x g£¬øł¾Ż¼īŹ½Ģ¼ĖįĶ·Ö½ā·½³ĢŹ½£¬ĄūÓĆ²īĮæ·ØĮŠ·½³Ģ¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©ÅØĻõĖįÓėĶ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖCu+4H++2NO3-=Cu2++2NO2”ü+2H2O£¬
¹Ź“š°øĪŖ£ŗCu+4H++2NO3-=Cu2++2NO2”ü+2H2O£»
£Ø2£©Ķعż¹Ų±Õ»īČūb£¬“ņæŖ»īČūa£¬ĶØČėŅ»¶ĪŹ±¼äæÕĘų²Ł×÷£¬æÉŅŌ½«×°ÖĆÖŠµÄÓŠ¶¾ĘųĢåµ¼ČėĒāŃõ»ÆÄĘČÜŅŗÖŠ£¬ČĆĒāŃõ»ÆÄĘČÜŅŗ³ä·ÖĪüŹÕ£¬
¹Ź“š°øĪŖ£ŗ¹Ų±Õ»īČūb£¬“ņæŖ»īČūa£¬ĶØČėŅ»¶ĪŹ±¼äæÕĘų£»
£Ø3£©Ė®Ō”¼ÓČČĖłŠčŅĒĘ÷ÓŠÉÕ±”¢ĪĀ¶Č¼Ę£¬ĶعżĻ“µÓæɳżČ„¼īŹ½Ģ¼ĖįĶ±ķĆęµÄĪüø½µÄĻõĖįÄĘ£¬
¹Ź“š°øĪŖ£ŗÉÕ±”¢ĪĀ¶Č¼Ę£»Ļ“Č„¼īŹ½Ģ¼ĖįĶ±ķĆęĪüø½µÄNa+ŗĶNO3-£»
£Ø4£©¼ģŃéĢ¼ĖįøłµÄ·½·ØĪŖ£ŗČ”ĀĖŅŗÉŁŠķÓŚŹŌ¹ÜÖŠ£¬ĻņĘäÖŠµĪ¼ÓĻ”ŃĪĖį£¬Õńµ“£¬½«²śÉśµÄĪŽÉ«ĪŽĪ¶µÄĘųĢåĶØČė³ĪĒåŹÆ»ŅĖ®ÖŠ£¬ČōŹÆ»ŅĖ®±ä»ė×Ē£¬ŌņĀĖŅŗÖŠŗ¬ÓŠCO32-£¬
¹Ź“š°øĪŖ£ŗČ”ĀĖŅŗÉŁŠķÓŚŹŌ¹ÜÖŠ£¬ĻņĘäÖŠµĪ¼ÓĻ”ŃĪĖį£¬Õńµ“£¬½«²śÉśµÄĪŽÉ«ĪŽĪ¶µÄĘųĢåĶØČė³ĪĒåŹÆ»ŅĖ®ÖŠ£¬ČōŹÆ»ŅĖ®±ä»ė×Ē£¬ŌņĀĖŅŗÖŠŗ¬ÓŠCO32-£»
£Ø5£©Įīѳʷ֊¼īŹ½Ģ¼ĖįĶµÄÖŹĮæ·ÖŹżĪŖx£¬¼īŹ½Ģ¼ĖįĶµÄÖŹĮæĪŖ2.42x g£¬Ōņ£ŗ
Cu2£ØOH£©2CO3$\frac{\underline{\;\;”÷\;\;}}{\;}$2CuO+H2O+CO2”ü ÖŹĮæ¼õÉŁ
222 62
2.42x g 2.42g-1.8g=0.62g
ĖłŅŌ£¬222£ŗ62=2.42x g£ŗ0.62g
½āµĆx=91.7%
¹Ź“š°øĪŖ£ŗ91.7%£®
µćĘĄ ±¾Ģā½čÖśÖĘČ”¼īŹ½Ģ¼ĖįĶÖĘ·Øæ¼²éĮĖĄė×Ó·½³ĢŹ½ŹéŠ“”¢ÖŹĮæ·ÖŹż¼ĘĖćµČÖŖŹ¶£¬³ä·Öæ¼²éĮĖѧɜµÄ·ÖĪö”¢Ąķ½ā”¢¼ĘĖćÄÜĮ¦£¬ŹĒŅ»µĄ²»“ķµÄĢāÄ棬±¾ĢāÄѶČÖŠµČ£®


 æĪæĪÓÅÄÜĮ¦ÅąÓÅ100·ÖĻµĮŠ“š°ø
æĪæĪÓÅÄÜĮ¦ÅąÓÅ100·ÖĻµĮŠ“š°ø ÓÅ°Ł·ÖæĪŹ±»„¶ÆĻµĮŠ“š°ø
ÓÅ°Ł·ÖæĪŹ±»„¶ÆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ČēĶ¼ĪŖ¹¤ŅµÉĻĀČ¼ī¹¤ŅµµÄµē½ā²ŪŹ¾ŅāĶ¼£¬¾ŻĶ¼»Ų“š£ŗ
ČēĶ¼ĪŖ¹¤ŅµÉĻĀČ¼ī¹¤ŅµµÄµē½ā²ŪŹ¾ŅāĶ¼£¬¾ŻĶ¼»Ų“š£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Õż¶”ĆŃ³£ÓĆ×÷ÓŠ»ś·“Ó¦µÄČܼĮ£®ŹµŃéŹŅÖʱøÕż¶”Ćѵķ“Ó¦ŗĶÖ÷ŅŖŹµŃé×°ÖĆČēĻĀ£ŗ
Õż¶”ĆŃ³£ÓĆ×÷ÓŠ»ś·“Ó¦µÄČܼĮ£®ŹµŃéŹŅÖʱøÕż¶”Ćѵķ“Ó¦ŗĶÖ÷ŅŖŹµŃé×°ÖĆČēĻĀ£ŗ| Ļą¶Ō·Ö×ÓÖŹĮæ | ·Šµć/”ę | ĆܶČ/£Øg•cm-3£© | Ė®ÖŠČܽāŠŌ | |
| Õż¶”“¼ | 74 | 117.2 | 0.8109 | Ī¢ČÜ |
| Õż¶”ĆŃ | 130 | 142.0 | 0.7704 | ¼øŗõ²»ČÜ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1molNa2O2ÓėĖ®·“Ó¦×ŖŅʵē×ÓŹżĪŖ0.2 NA | |
| B£® | ±ź×¼×“æöĻĀ£¬11.2L CCl4ÖŠŗ¬ÓŠµÄ·Ö×ÓŹżĪŖ0.5NA | |
| C£® | 1mol SŌŚ×ćĮæO2ÖŠČ¼ÉÕ£¬×ŖŅʵĵē×ÓŹżĪŖ4NA | |
| D£® | 0.2 mol Cl2ČÜÓŚĖ®ÖŠ£¬×ŖŅʵē×ÓŹżĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Cl2 | B£® | KMnO4 | C£® | FeCl3 | D£® | HCl |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹żŃõ»ÆÄĘÓėĖ®µÄ·“Ó¦£ŗO2-+H2O=2OH- | |
| B£® | ½šŹōÄĘÓėĖ®µÄ·“Ó¦£ŗNa+H2O=Na++OH-+H2”ü | |
| C£® | ½šŹōÄĘÓėĮņĖįĶČÜŅŗµÄ·“Ó¦£ŗ2Na+Cu2+=Cu+2Na+ | |
| D£® | ĮņĖįĒāÄĘČÜŅŗÓėĢ¼ĖįĒāÄĘČÜŅŗµÄ·“Ó¦£ŗH++HCO3-=H2O+CO2”ü |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com