
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
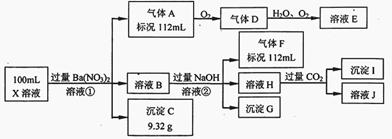
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
【知识点】离子反应 离子方程式的书写 电荷守恒用于计算B1 B3
【答案解析】(1) Fe3+ 、Cl-(2分) 取少量B溶液于试管中,向其中滴加AgNO3溶液,若有白色沉淀生成,说明存在Cl—,否则Cl—不存在。(其它合理答案也可)。(2分)
(2) 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O (2分)
Al3+ +4OH—=AlO2—+2H2O(2分)
8NH3+3Cl2=6 NH4Cl+N2(2分)
(3) 0.15 0.1 0.4 (各1分)
解析:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子。根据离子间的反应溶液中含有Fe2+离子就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是Fe3+和Cl-,
若要用实验证明该阴离子是否存在,最可靠的化学方法是:取少量B溶液于试管中,向其中滴加AgNO3溶液,若有白色沉淀生成,说明存在Cl—,否则Cl—不存在。
(2)
①中生成气体A:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
②中生成溶液H:Al3+ +4OH—=AlO2—+2H2O
③中产生的气体F遇氯气产生白烟:8NH3+3Cl2=6 NH4Cl+N2
(3)根据3Fe2++4H++NO3-=3Fe3++NO+2H2O,利用NO的体积是112mL得Fe2+的物质的量为3×(112mL/22400mL)=0.015mol, c(Fe2+)=0.15mol/L;消耗的氢离子的物质的量为4×(112mL/22400mL)=0.02mol;过量的氢离子的物质的量为2mol/L×0.01L=0.02mol,
原100mLx溶液中c(H+)=(0.02+0.02)mol/0.1L=0.4mol/L
F为NH3,所以c(NH4+)=(112mL/22400mL)/0.1L=0.05mol/L;
溶液中C(Al3+)=(0.03-0.025)mol/0.1L=0.05mol/L;
溶液中c(Fe3+)=0.025mol/0.1L-0.15mol/L=0.1mol/L;
溶液中c(SO42-)=(9.32g/233g/mol)/0.1L=0.4mol;
利用电荷守恒得:0.4×1+0.15×2+0.05×1+0.05×3+0.1×3 =0.4×2+c(Cl-)×1;解得c(Cl-)=0.4mol/L
则原溶液中c(Fe2+)为0.15mol/L、c(Fe3+)为0.1mol/L、c(Cl-)为0.4mol/L。
【思路点拨】本题以框图推断的形式考查了离子反应、离子方程式的书写、利用溶液中电荷守恒进行计算,(3)的计算繁琐,溶液因丢落离子而导致错误出现,分析需严谨。


科目:高中化学 来源: 题型:
分子式与苯丙氨酸(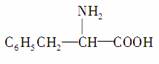 )相
)相
同,且同时符合下列两个条件:①有带两个取代基的苯环;②有一个硝基直接连接在苯环上。那么,这种物质的异构体的数目是( )
A.3种 B.5种
C.6种 D.10种
查看答案和解析>>
科目:高中化学 来源: 题型:
NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如图: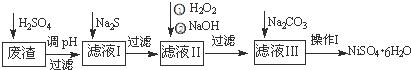
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 :
(2)加6%的H2O2时,温度不能过高,其目的是
(3)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀.在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为
(4)上述流程中滤液Ⅲ的主要成分是
(5)操作Ⅰ包括以下过程:过滤,溶解, , ,洗涤获得NiSO4•6H2O晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧ C②⑤⑥⑦ D.①④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1) 过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:
(2) Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是____________(写电子式),
(3) 臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:
KI+O3+H2O→KOH+I2+O2(未配平 ) 回答问题:
① 还原产物的化学式为
② 配平后的化学方程式是
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
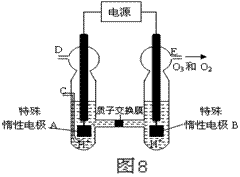

①图中阴极为 (填“A”或“B”)。
② 若C处不通入O 2 ,D、E处分别收集到11.2L和4.48L
气体(标准状况下), 则E处收集的气体中O3所占的体积分数
为 (忽略 O 3 的分解)。
③ 若C处通入O 2,则A极的电极反应式为: 。
(5)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如图9)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如图9)所示。由图可得出的正确说法是
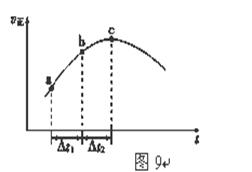
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.Δt1=Δt2时,NO的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
镁、铁等物质,加碘盐中碘的损失主要由于杂质、水份、空气中的氧气以及光照,受热而引起的。
已知: 氧化性: IO3— >Fe3+ >I2 还原性:S2O32— > I—
反应式:3I2 + 6OH— == 5I— + IO3— + 3H2O KI + I2 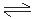 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)。用适量蒸馏水溶解,并加稀硫酸酸化,将所得溶液分3份:第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显示淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入足量的KIO3固体后,滴加淀粉试剂,溶液不变色。
① 该红色物质是 (用化学式表示);CCl4中显示紫红色的物质是 (用电子式表示)。
② 第二份试液中加入足量KI固体后,反应的离子方程式为 ; 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?
(填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
A. Na2S2O3 B. AlCl3 C. Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O= 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是( )
A、该反应中 Fe2+是还原剂,O2 是还原产物
B、4molNa2O2 在反应中共得到 8NA 的电子
C、Fe(OH)3 既是氧化产物又是还原产物,每生成 4mol Fe(OH)3 反应过程中共转移电子 6mol
D、反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com