(2013?房山区一模)碳化硅(SiC)、氧化铝(Al
2O
3) 和氮化硅(Si
3N
4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
(1)Al的原子结构示意图为
;Al与NaOH溶液反应的离子方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为
Si3N4+16HF=4NH4F+3SiF4
Si3N4+16HF=4NH4F+3SiF4
.
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl
4(g)+2N
2(g)+6H
2(g)
Si
3N
4(s)+12HCl(g)△H<0
某温度和压强条件下,分别将0.3mol SiCl
4(g)、0.2mol N
2(g)、0.6mol H
2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si
3N
4(s)的质量是5.60g.
①H
2的平均反应速率是
0.024
0.024
mol/(L?min).
②平衡时容器内N
2的浓度是
0.06
0.06
mol?L
-1.
③SiCl
4(g)的转化率是
40%
40%
.
④若按n(SiCl
4):n(N
2):n(H
2)=3:2:6的投料配比,向上述容器不断扩大加料,SiCl
4(g)的转化率应
减小
减小
(填“增大”、“减”或“不变”).
⑤在不改变反应条件的情况下,为了提高SiCl
4(g)的转化率,可通过改变投料配比的方式来实现.下列四种投料方式,其中可行的是
AB
AB
.
| 选项 |
投料方式 |
| A |
n(SiCl4):n(N2):n(H2)=1:1:2 |
| B |
n(SiCl4):n(N2):n(H2)=1:2:2 |
| C |
n(SiCl4):n(N2):n(H2)=3:2:2 |
| D |
n(SiCl4):n(N2):n(H2)=2:1:3 |



 ,
, ;2Al+2OH-+2H2O=2AlO2-+3H2↑;
;2Al+2OH-+2H2O=2AlO2-+3H2↑;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案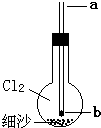 (2013?房山区一模)如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠.从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应.下列对此实验的说法中,不正确的是( )
(2013?房山区一模)如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠.从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应.下列对此实验的说法中,不正确的是( )