
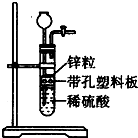
 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④汽油⑤Na2C03溶液⑥KCl溶液( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④汽油⑤Na2C03溶液⑥KCl溶液( )| A. | ①②③ | B. | ②④⑤ | C. | ②③④⑥ | D. | ②③⑥ |
分析 在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,可加入互溶或密度比水大的有机物,或加水溶液,但硝酸盐在酸性溶液中具有强氧化性,与Zn反应不生成氢气,以此来解答.
解答 解:①加NaN03溶液,与Zn、硫酸发生氧化还原反应不生成氢气,故不选;
②酒精使溶液总体积变大,可使液面浸没锌粒,继续反应生成氢气,故选;
③四氯化碳不溶于水,密度比水大,在下层,可使液面浸没锌粒,继续反应生成氢气,故选;
④汽油的密度比水的密度小,分层后在上层,隔绝酸与Zn,不能生成气体,故不选;
⑤Na2C03溶液可与硫酸反应生成二氧化碳,消耗酸,不利于氢气的生成,故不选;
⑥KCl溶液使溶液总体积变大,可使液面浸没锌粒,继续反应生成氢气,故选;
故选D.
点评 本题考查实验装置的综合应用,为高频考点,把握物质的性质、发生的反应及酸液与Zn接触的方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 1:24 | D. | 24:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶液的浓度大于氢氧化钠溶液 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | c(NH3•H2O)+c(NH4+)=0.001 mol•Lˉ1 | |
| D. | 往两溶液中加入盐酸恰好中和,则反应后溶液的pH值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
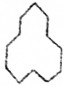 名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.
名称是环十二烷;1mol该烃完全燃烧需消耗的氧气18mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释Na2CO3溶液时,C(HCO3-)、$\frac{C(O{H}^{-})}{C(C{{O}_{3}}^{2-})}$均增大 | |
| B. | 常温下,反应4Fe(OH)2(s)+2H2O(I)+O2(g)=4Fe(OH)3(s)的△H<0,△S>0 | |
| C. | 用0.1mol•L-1CH3COOH溶液滴定0.1mol•L-1 NaOH至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+) | |
| D. | 向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com