
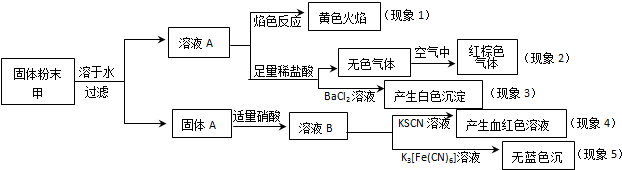
| A. | 根据现象1可推出该固体粉末中含有钠元素,但一定不含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定不含有NaNO2 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定不含FeO |
分析 焰色反应呈黄色,说明含有钠元素,则至少含有NaNO2、Na2SO4中的一种,因未透过蓝色钴玻璃,不能确定是否含有钾元素,红棕色气体为NO2,说明生成NO,如含有NaNO2,加入盐酸则发生2NaNO2+2HCl=2NaCl+NO↑+NO2↑+H2O,可立即观察到有红棕色气体生成,加入氯化钡生成白色沉淀,应为硫酸钡,但不能说明含有Na2SO4,加入KSCN生成血红色溶液,说明含有铁离子,而加入K3[Fe(CN)6]溶液无现象,说明加入硝酸后溶液中无Fe2+,以此解答该题.
解答 解:焰色反应呈黄色,说明含有钠元素,则至少含有NaNO2、Na2SO4中的一种,因未透过蓝色钴玻璃,不能确定是否含有钾元素,红棕色气体为NO2,说明生成NO,如含有NaNO2,加入盐酸则发生2NaNO2+2HCl=2NaCl+NO↑+NO2↑+H2O,可立即观察到有红棕色气体生成,加入氯化钡生成白色沉淀,应为硫酸钡,但不能说明含有Na2SO4,加入KSCN生成血红色溶液,说明含有铁离子,而加入K3[Fe(CN)6]溶液无现象,说明加入硝酸后溶液中无Fe2+,
A.钠的焰色反应为黄色,故一定含钠元素,观察钾的焰色反应须透过钴玻璃,避免钠的干扰,故无法确定是否含钾,故A错误;
B.如含有NaNO2,加入盐酸则发生2NaNO2+2HCl=2NaCl+NO↑+NO2↑+H2O,可立即观察到有红棕色气体生成,而题给现象没有立即生成红棕色气体,说明不含NaNO2,故B正确;
C.现象3加入氯化钡生成白色沉淀,应为硫酸钡,但不能说明含有Na2SO4,可由K2SO3氧化生成,故C错误;
D.固体A加入具有强氧化性的硝酸,可氧化亚铁离子,不能说明固体粉末中是否含FeO,故D错误.
故选B.
点评 本题考查物质的检验和鉴别的实验方案的设计以及无机物的推断,侧重于元素化合物知识的综合运用,题目难度中等,注意把握反应的现象,根据现象结合物质的性质进行判断,易错点为A和C,注意体会.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Cl | B. | 热稳定性:HCI<HF | ||
| C. | 离子半径:F-<Mg2+ | D. | 碱性:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热 | |
| B. | 热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量 | |
| C. | 1 mol碳燃烧所放出的热量为燃烧热 | |
| D. | 热化学方程式中的化学计量数表示物质的量,因此可用分数表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 试管内壁附着的硫黄可以用热的KOH溶液洗涤,也可以用CS2洗涤 | |
| B. | 盛Na2SO3、Na2S溶液的试剂瓶不能用玻璃塞,贮存时应盖好瓶塞,防止被空气氧化 | |
| C. | 金属镁着火可使用扑救金属火灾的专用干粉灭火剂灭火,但不可用泡沫灭火器灭火 | |
| D. | 从硫酸亚铁铵溶液中获取硫酸亚铁铵晶体,可以用蒸发结晶,也可以用冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径C>D>E | |
| B. | A2E6分子中各原子均满足8电子结构 | |
| C. | 气态氢化物的稳定性HmE>HnD | |
| D. | B、C形成的化合物中只可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
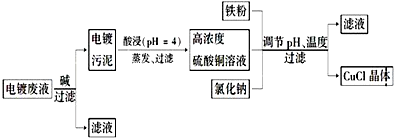
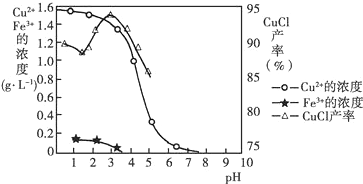
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、CO32- | B. | H+、Na+、ClO-、Cl- | ||
| C. | K+、HCO3-、Cl-、OH- | D. | Na+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
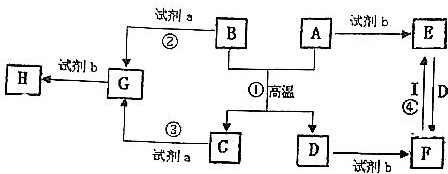
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com